题目内容
指出下列盐的水溶液的酸碱性,若有发生水解的,请写出水解的离子方程式.
(1)NH4NO3溶液呈 性, ;
(2)NaClO溶液呈 性, ;
(3)CH3COOK溶液呈 性, ;
(4)Fe2(SO4)3溶液呈 性, .
(1)NH4NO3溶液呈
(2)NaClO溶液呈
(3)CH3COOK溶液呈
(4)Fe2(SO4)3溶液呈
考点:盐类水解的原理,离子方程式的书写
专题:盐类的水解专题
分析:题中NH4NO3和Fe2(SO4)3为强酸弱碱盐,水解呈酸性,NaClO和CH3COOK为强碱弱酸盐,水解呈碱性,以此解答该题.
解答:
解:(1)NH4NO3中含有铵根弱离子,结合水中氢氧根离子生成一水合氨,反应的离子方程式为NH4++H2O?NH3?H2O+H+,溶液呈酸性,
故答案为:酸; NH4++H2O?NH3?H2O+H+;
(2)NaClO为强碱弱酸盐,水解呈碱性,离子方程式为 ClO-+H2O?HClO+OH-,故答案为:碱; ClO-+H2O?HClO+OH-;
(3)醋酸钾含有弱离子醋酸根离子在水溶液中水解,水解离子方程式为CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性,
故答案为:碱; CH3COO-+H2O?CH3COOH+OH-;
(4)Fe2(SO4)3为强酸弱碱盐,铁离子在水溶液中结合氢氧根;离子生成氢氧化铁,溶液呈酸性,反应的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,
故答案为:酸; Fe3++3H2O?Fe(OH)3+3H+.
故答案为:酸; NH4++H2O?NH3?H2O+H+;
(2)NaClO为强碱弱酸盐,水解呈碱性,离子方程式为 ClO-+H2O?HClO+OH-,故答案为:碱; ClO-+H2O?HClO+OH-;
(3)醋酸钾含有弱离子醋酸根离子在水溶液中水解,水解离子方程式为CH3COO-+H2O?CH3COOH+OH-,溶液呈碱性,
故答案为:碱; CH3COO-+H2O?CH3COOH+OH-;
(4)Fe2(SO4)3为强酸弱碱盐,铁离子在水溶液中结合氢氧根;离子生成氢氧化铁,溶液呈酸性,反应的离子方程式为Fe3++3H2O?Fe(OH)3+3H+,
故答案为:酸; Fe3++3H2O?Fe(OH)3+3H+.
点评:本题考查了盐类水解的实质、规律、反应离子方程式书写,为高频考点,题目着重于双基知识的考查,注意把握水解规律和原理,题目较简单.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
相同质量的SO2和SO3它们之间的关系是( )
| A、所含硫原子的物质的量之比为1:1 |
| B、氧原子的物质的量之比为3:2 |
| C、所含硫原子的个数之比为5:4 |
| D、氧原子的个数比为3:2 |
 16、下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )
16、下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )| A、已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B-B键、12个硼原子 |
| B、SF6的分子空间构型为正八面体 |
| C、1 molHCN分子中有2 molσ键和2molπ键 |
| D、32gS8分子中含有0.125 molσ键 |
下列说法中正确的是( )
| A、水溶液中,1mol KCl和1mol NaCl电离出的氯离子一样多 |
| B、电解质Ba(OH)2的电离方程式为:Ba(OH)2=Ba2++OH- |
| C、凡溶于水后能电离出H+的物质都是酸 |
| D、BaSO4的水溶液不导电,BaSO4属非电解质 |
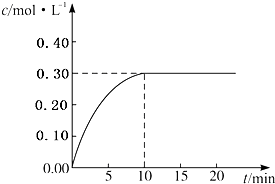 目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示:
目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示: