题目内容
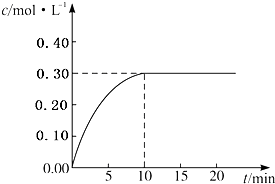 目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示:
目前工业上通常用生产水煤气的方法获得,反应的化学方程为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.若在某一容积为4L的密闭容器内,加入2.0mol的CO和3.0mol的H2O(g),在催化剂存在的条件下于850℃高温加热,发生上述反应,反应中CO2的浓度随时间变化情况如图所示:(1)①根据上图数据,请计算出在850℃时该反应的化学平衡常数K(850℃)=
(3)若该反应的在750℃时达到化学平衡状态,则此时的平衡常数K(750℃)
(3)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3.0mol H2O(g)、10mol的CO2和x mol H2,则:
①当x=5.0时,上述反应向
②若要使上述反应开始向正反应方向进行,则x应满足的条件是
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%和b%,则a
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值进行解答;平衡时CO的转化率等于转化量与起始量之比;
(2)正反应放热,故升温平衡左移,平衡常数减小;
(3)①反应混合物各物质的量系数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数k的关系判断.Qc>k平衡向逆反应进行,Qc=k反应处于平衡状态,Qc<k平衡向正反应进行;
②用x表示出浓度商Qc,平衡向正反应移动,应满足浓度商Qc<k,据此计算判断;
③增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的.
(2)正反应放热,故升温平衡左移,平衡常数减小;
(3)①反应混合物各物质的量系数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数k的关系判断.Qc>k平衡向逆反应进行,Qc=k反应处于平衡状态,Qc<k平衡向正反应进行;
②用x表示出浓度商Qc,平衡向正反应移动,应满足浓度商Qc<k,据此计算判断;
③增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的.
解答:
解:(1)①利用三段式法计算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度/(mol?L-1 ):
0 0
转化浓度/(mol?L-1 ):0.3 0.3 0.3 0.3
平衡浓度/(mol?L-1 ):0.2 0.45 0.3 0.3
因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K(850℃)=
=
=1,
故答案为:1;
②平衡时CO的转化率=
×100%=60%,故答案为:60%;
(2)CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,正反应放热,故升温平衡左移,平衡常数减小,K(750℃)大于K(850℃),故答案为:大于;
(3)①此时的浓度商Qc=
=1.67,大于平衡常数1,故平衡向逆反应方向移动,故答案为:逆反应;
②平衡向正反应方向移动,浓度商小于平衡常数,即
<1,解得x<3,故答案为:x<3;
③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%,
故答案为:小于.
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度/(mol?L-1 ):
| 2 |
| 4 |
| 3 |
| 4 |
转化浓度/(mol?L-1 ):0.3 0.3 0.3 0.3
平衡浓度/(mol?L-1 ):0.2 0.45 0.3 0.3
因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K(850℃)=
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| 0.3×0.3 |
| 0.2×0.45 |
故答案为:1;
②平衡时CO的转化率=
| 0.3 |
| 0.5 |
(2)CO(g)+H2O(g)═CO2(g)+H2(g)△H<0,正反应放热,故升温平衡左移,平衡常数减小,K(750℃)大于K(850℃),故答案为:大于;
(3)①此时的浓度商Qc=
| 1×5 |
| 1×3 |
②平衡向正反应方向移动,浓度商小于平衡常数,即
| 1×x |
| 1×3 |
③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为a%<b%,
故答案为:小于.
点评:本题考查转化率、化学平衡有关计算、化学平衡移动与影响因素等,注意平衡常数的应用、平衡移动的本质是解答的关键,题目难度中等.

练习册系列答案
相关题目
关于化学平衡常数的叙述正确的是( )
| A、化学平衡常数与温度无关 |
| B、两种物质反应,不管怎样书写化学方程式,平衡常数不变 |
| C、化学平衡常数等于某时刻生成物浓度幂之积与反应物浓度幂之积的比值 |
| D、温度一定,对于给定的化学反应,正逆反应的平衡常数互为倒数 |
下列各组内离子之间不能发生离子反应的是( )
| A、HCO3-、NH4+、H+、Ca2+ |
| B、SO42-、H+、Cl-、NO3- |
| C、K+、Ag+、Na+、CO32- |
| D、Mg2+、OH-、SO32-、Cl-- |
相同温度相同物质的量浓度的六种溶液:①NaHCO3 ②CH3COONa ③NaOH④Ba(OH)2 ⑤NaHSO4 ⑥H3PO4 按pH值由大到小的顺序是( )
| A、⑥⑤②①④③ |
| B、⑥⑤①②③④ |
| C、④③②①⑤⑥ |
| D、④③①②⑥⑤ |

 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答: