题目内容
15.对于A(?)+2B(g)?nC(g),在一定条件下达到平衡后,改变下列条件,请回答:(1)A量的增减,平衡不移动,则A为固或液态.
(2)增压,平衡不移动,当n=3时,A为气态.
(3)若A为固态,增大压强,C的组分含量减少,则n>2.
(4)升温,平衡向右移动,则该反应的逆反应为放热反应.
分析 (1)固体或纯液体物质,物质的量增加减少不影响化学平衡;
(2)增压,平衡不移动,则反应物、生成物气体的化学计量数之和相等;
(3)增大压强,平衡向着体积减小的方向移动;
(4)升高温度,化学平衡向着吸热方向移动.
解答 解:(1)A量的增减,平衡不移动,说明A是固体或纯液体,固体的物质的量不影响化学平衡,故答案为:固或液;
(2)增压,平衡不移动,说明反应前后气体总体积相等,当n=3时,A一定为气态,故答案为:气;
(3)A为固态时,增大压强,C的百分含量减小,则正反应为气体体积缩小的反应,故n>2,故答案为:>2;
(4)升高温度,平衡向着吸热反应方向移动,则正反应为吸热反应,逆反应为放热反应,故答案为:放.
点评 本题考查了化学平衡及其影响因素,题目难度中等,明确影响化学平衡的因素为解答关键,注意掌握温度、压强、浓度等因素对化学平衡的影响,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
6. 同压、不同温度下的反应:A(g)+B(g)?C(g)△H,A的含量和温度的关系如图所示,下列结论正确的是( )
同压、不同温度下的反应:A(g)+B(g)?C(g)△H,A的含量和温度的关系如图所示,下列结论正确的是( )
 同压、不同温度下的反应:A(g)+B(g)?C(g)△H,A的含量和温度的关系如图所示,下列结论正确的是( )
同压、不同温度下的反应:A(g)+B(g)?C(g)△H,A的含量和温度的关系如图所示,下列结论正确的是( )| A. | T1>T2,△H>0 | B. | T1<T2,△H>0 | C. | T1>T2,△H<0 | D. | T1<T2,△H<0 |
3.下列说法中正确的是( )
| A. | 摩尔是物质的量的单位,含有6.02×1023个微粒的物质叫做1摩尔 | |
| B. | 1mol氧含有6.02×1023个氧原子 | |
| C. | 1mol气体的体积随压强增大和温度降低而变小 | |
| D. | 标准状况下,体积相等的CCl4和Cl2,前者含有的氯原子数是后者的两倍 |
10.下列溶液中通入过量二氧化碳,一定没有白色沉淀产生的是( )
| A. | Ca(OH)2 | B. | NaAlO2 | C. | Na2SiO3 | D. | 饱和Na2CO3 |
20.按以下实验方案可以从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物.下列说法错误的是( )
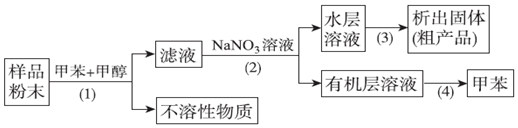

| A. | 步骤(1)需要过滤装置 | |
| B. | 步骤(3)需要用到蒸发皿 | |
| C. | 活性天然产物易溶于有机溶剂难溶于水 | |
| D. | 步骤(4)是利用物质沸点差异进行分离的 |
7.将过氧化钠投入到FeCl2溶液中,可观察到的实验现象是( )
| A. | 有无色、刺激气味气体产生 | |
| B. | 有白色沉淀生成 | |
| C. | 有红褐色沉淀生成 | |
| D. | 有白色沉淀生成,很快变成灰绿色,最后变为红褐色 |
4.对于可逆反应N2(g)+3H2(g)?2NH3(g)下列各项表示的是在4种不同情况下的反应速率,其中反应速率最快的是( )
| A. | V(N2)=0.01mol/(L•S) | B. | V(H2)=0.2mol/(L•S) | ||
| C. | V(H2)=0.6mol/(L•min) | D. | V(NH3)=1.2mol/(L•min) |
5.某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3-,已知其中Na+、K+、Ca2+、NO3-的浓度均为0.1mol•L-1,则Cl-的物质的量浓度为( )
| A. | 0.1mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.4mol•L-1 |