题目内容
1.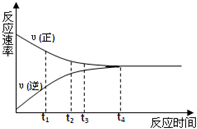 一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )
一定条件下的某可逆反应,其正反应速率V正和逆反应速率V逆随时间的变化如图所示,下列判断不正确的是( )| A. | t3时刻,υ(正)>υ(逆) | B. | t4时刻,υ(正)=υ(逆) | ||
| C. | t4时刻,反应达到最大限度 | D. | t4时刻,反应停止 |
分析 由图可知,从开始至t4时υ(正)>υ(逆),t4时刻,υ(正)=υ(逆)达到反应的最大限度,以此来解答.
解答 解:A.t3时刻,没有达到化学平衡,由图可知υ(正)>υ(逆),故A正确;
B.t4时刻,υ(正)=υ(逆),达到化学平衡状态,故B正确;
C.t4时刻,达到化学平衡状态,反应达到最大限度,故C正确;
D.t4时刻,达到化学平衡状态,为动态平衡,反应没有停止,故D错误;
故选D.
点评 本题考查化学平衡的建立,为高频考点,把握反应速率的关系、平衡状态的建立为解答的关键,侧重分析与应用能力的考查,注意平衡时υ(正)=υ(逆)≠0,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
12.“低碳经济”是以低能耗、低污染、低排放为基础的可持续发展经济模式.下列说法与“低碳经济”不符合的是( )
| A. | 加强对煤、石油、天然气等综合利用的研究,提高燃料的利用率 | |
| B. | 大力研发新型有机溶剂替代水作为萃取剂 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 使用甲醇、乙醇混合型汽油可以减少对大气的污染 |
9.下列关于电化学知识说法正确的是( )
| A. | 任何化学反应都可以设计成电解池反应 | |
| B. | 电解冶炼镁、铝通常电解MgCl2和Al2O3,也可电解MgO和 | |
| C. | 若把Cu+H2SO4═CuSO4+H2↑设计成电解池,应用Cu作阳极 | |
| D. | 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
16.下列说法不正确的是( )
| A. | 高级脂肪酸甘油酯的碱性水解叫皂化反应 | |
| B. | 含淀粉或纤维素的物质可以酿酒 | |
| C. | 鸡蛋清的溶液中加入饱和氯化钠溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
6.俄国化学家制出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑.这位化学家是( )
| A. | 汤姆生 | B. | 道尔顿 | C. | 拉瓦锡 | D. | 门捷列夫 |
13.若NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,5.6 LCCl4含有的分子数为0.25NA | |
| B. | 常温常压下,8g CH4含有的分子数为0.5NA | |
| C. | 7.8g Na2O2与足量水反应,转移电子数为0.2NA | |
| D. | 常温下,0.1mol Fe与酸完全反应时,失去的电子数一定为0.3NA |
10.关于证明海带中存在碘元素的实验,以下操作正确的是( )
| A. | 海带中的碘可以直接用四氯化碳萃取 | |
| B. | 在蒸发皿中灼烧海带使之变为海带灰 | |
| C. | 将海带灰溶于水中,滴加淀粉溶液,溶液变蓝 | |
| D. | 为了将I-氧化,加入的氧化剂最好选择H2O2溶液 |
11.电池是人类生产和生活中的重要的能量来源,各式各样电池的发明是化学对人类的一项重大贡献.下列有关电池的叙述正确的是( )
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,锌作负极 | |
| C. | 在电池中,电子流出的一极是负极,发生还原反应 | |
| D. | 银锌纽扣电池工作时,电子由锌极流出经过溶液后流向银极 |