题目内容
16.有关化学键的说法正确的是( )| A. | 全部由非金属元素构成的化合物一定是共价化合物 | |
| B. | 某元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键 | |
| C. | 金属与非金属原子间只能形成离子键 | |
| D. | 含有共价键的化合物不一定是共价化合物 |
分析 A.铵盐全部由非金属元素组成,为离子化合物;
B.氯化氢为共价键;
C.一般金属元素与非金属元素形成离子键,如AlCl3为共价化合物;
D.氯化铵中含有共价键,但为离子化合物.
解答 解:A.因铵盐全部由非金属元素组成,为离子化合物,则全部由非金属元素形成的化合物不一定是共价化合物,故A错误;
B.氢原子最外层有1个电子,但氯化氢内为共价键,故B错误;
C.一般金属元素与非金属元素形成离子键,如AlCl3为共价化合物,故C错误;
D.氯化铵中含有共价键,但为离子化合物,故D正确;
故选D.
点评 本题考查化学键及化合物的类别,熟悉一般金属元素与非金属元素形成离子键,非金属元素之间形成共价键及特殊物质中的化学键即可解答,注意利用实例来分析解答.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
7.下列有关化学反应速率的认识,正确的是( )
| A. | 增大压强(对于气体反应),活化分子总数必然增大,故反应速率增大 | |
| B. | 温度升高,分子动能增加,减小了活化能,故反应速率增大 | |
| C. | 选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 | |
| D. | H+和OH-的反应活化能非常小,反应几乎在瞬间完成 |
4.用过量锌与稀硫酸反应制H2时,下列能延缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量蒸馏水 | D. | 改用98%的浓硫酸 |
1.正确掌握化学用语是学好化学的基础,下列化学用语正确的是( )
| A. | 乙酸的实验式:C2H4O2 | B. | 苯乙醛的结构简式: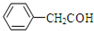 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 丙烷分子的球棍模型: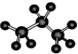 |
8.设阿伏加德罗常数的值为NA,下列说法中不正确的是( )
| A. | 1mol甲基(-CH3)含有的电子数目为9NA | |
| B. | 28g乙烯和丙烯的混合气体中所含碳原子数为2NA | |
| C. | 1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为NA | |
| D. | 25℃时,1mol己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA |
5.氮化铝(AlN)常用做砂轮及高温炉衬材料,熔化状态下不导电,可知它属于( )
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 无法判断 |
6.下列说法不正确的是( )
| A. | 化学反应速率是通过实验测定的 | |
| B. | 升高温度,只能增大吸热反应速率,不能增大放热反应速率 | |
| C. | 对于任何反应,增大压强,相当于增大反应物的浓度,反应速率都加快 | |
| D. | 催化剂可降低反应所需活化能,提高活化分子百分数,从而提高反应速率 |
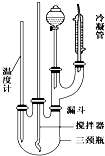 硝基苯是一种重要的化工原料,其制备原理是:
硝基苯是一种重要的化工原料,其制备原理是: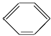 +HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$
+HO-NO2$→_{50~60℃}^{H_{2}SO_{4}}$ 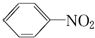 +H2O△H<0
+H2O△H<0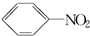 +HO-NO2$→_{△}^{H_{2}SO_{4}}$
+HO-NO2$→_{△}^{H_{2}SO_{4}}$ 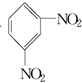 +H2O
+H2O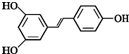 .根据要求回答下列问题:
.根据要求回答下列问题: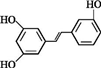 .
.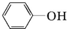 )都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.
)都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.