题目内容
空气吹出法工艺,是目前“海水提溴”的最主要方法之一.其工艺流程如下:

(1)溴在周期表中位于 周期, 族.
(2)步骤①中用硫酸酸化可提高Cl2的利用率,为什么? .
(3)步骤④的离子方程式: .
(4)步骤⑧中溴蒸汽冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是 ,分离时液溴从分离器的 (填“上口”或“下口”)排出.
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”: .

(1)溴在周期表中位于
(2)步骤①中用硫酸酸化可提高Cl2的利用率,为什么?
(3)步骤④的离子方程式:
(4)步骤⑧中溴蒸汽冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离.分离仪器的名称是
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:
考点:海水资源及其综合利用
专题:实验题
分析:(1)根据溴的原子序数为35,原子结构中有4个电子层,最外层电子数为7来确定其在周期表中的位置;
(2)步骤②发生2Br-+Cl2=2Cl-+Br2,则步骤①中硫酸可减少副反应的发生;
(3)步骤④中二氧化硫具有还原性,溴单质具有氧化性,二者之间可以发生反应;
(4)实现大量液溴和少量溴水分离的方法是分液法,根据分液法的仪器以及仪器的使用方法来回答;
(5)氯化后的海水虽然含有溴单质,但浓度低,产量低.
(2)步骤②发生2Br-+Cl2=2Cl-+Br2,则步骤①中硫酸可减少副反应的发生;
(3)步骤④中二氧化硫具有还原性,溴单质具有氧化性,二者之间可以发生反应;
(4)实现大量液溴和少量溴水分离的方法是分液法,根据分液法的仪器以及仪器的使用方法来回答;
(5)氯化后的海水虽然含有溴单质,但浓度低,产量低.
解答:
解:(1)溴的原子序数为35,原子结构中有4个电子层,最外层电子数为7,所以溴在周期表中位于4周期VIIA族,故答案为:4;VIIA;
(2)步骤②发生2Br-+Cl2=2Cl-+Br2,则步骤①中硫酸可减少副反应的发生,即步骤①中用硫酸酸化可防止Cl2、Br2与水反应,故答案为:酸化可防止Cl2、Br2与水反应;
(3)步骤④发生SO2+Br2+2H2O=2HBr+H2SO4,离子反应为Br2+SO2+2H2O=4H++2Br-+SO42-,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(4)实现大量液溴和少量溴水分离的方法是分液法,采用的仪器为分液漏斗,操作时下层液体必须从下口流出,上层液体从上层倒出,故答案为:分液漏斗;下口;
(5)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高.“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,故答案为:溴的浓度太低、蒸馏效率低成本太高.
(2)步骤②发生2Br-+Cl2=2Cl-+Br2,则步骤①中硫酸可减少副反应的发生,即步骤①中用硫酸酸化可防止Cl2、Br2与水反应,故答案为:酸化可防止Cl2、Br2与水反应;
(3)步骤④发生SO2+Br2+2H2O=2HBr+H2SO4,离子反应为Br2+SO2+2H2O=4H++2Br-+SO42-,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(4)实现大量液溴和少量溴水分离的方法是分液法,采用的仪器为分液漏斗,操作时下层液体必须从下口流出,上层液体从上层倒出,故答案为:分液漏斗;下口;
(5)氯化后的海水虽然含有溴单质,但浓度低,如果直接蒸馏原料,产品成本高.“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,故答案为:溴的浓度太低、蒸馏效率低成本太高.
点评:本题考查海水提溴,把握流程中发生的化学反应及混合物分离方法为解答的关键,步骤①为解答的难点,注重工业流程和化学反应原理的考查,题目难度中等.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
化学与生产、生活、社会密切相关,下列说法正确的是( )
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解,会造成“白色污染” |
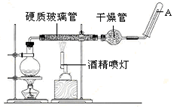 常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题. 如图为以惰性电极进行电解:
如图为以惰性电极进行电解: 化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:
化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全: