题目内容
 Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.
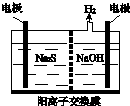
Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.(1)将烧碱吸收H2S后的溶液加入到如图所示的电解池的阳极区进行电解.电解过程中阳极区发生如下反应:
S2--2e-═S (n-1)S+S2-═Sn2-.
①写出电解时阴极的电极反应式:
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成
Ⅱ.用FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液.
FeCl3与H2S反应的离子方程式为
电解池中H+在阴极放电产生H2,阳极的电极反应为
综合分析的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②
考点:原电池和电解池的工作原理
专题:电化学专题
分析:Ⅰ(1)①阴极上氢离子放电生成氢气,阳极上硫离子放电,电极反应式为S2--2e-═S;
②Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S;
Ⅱ硫化氢与FeCl3溶液反应生成单质硫,H2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质;
电解氯化亚铁时,阴极阳离子得到电子发生还原反应;阳极阳离子失去电子发生氧化反应;
①根据FeCl3可以循环利用.
②Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应,同时S元素得电子生成H2S;
Ⅱ硫化氢与FeCl3溶液反应生成单质硫,H2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质;
电解氯化亚铁时,阴极阳离子得到电子发生还原反应;阳极阳离子失去电子发生氧化反应;
①根据FeCl3可以循环利用.
解答:
解:Ⅰ(1)①阳极上硫离子放电,电极反应式为S2--2e-═S,阴极上氢离子放电生成氢气,电极反应式为 2H2O+2e-=H2↑+2OH-,故答案为:2H2O+2e-=H2↑+2OH-;
②电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,故答案为:Sn2-+2H+=(n-1)S↓+H2S↑;
ⅡH2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质,本身被还原成Fe2+,由于H2S是弱电解质,故书写离子方程式时,应写其分子式,即2Fe3++H2S═S↓+2Fe2++2H+,故答案为:2Fe3++H2S═S↓+2Fe2++2H+;
电解氯化亚铁时,阴极发生氢离子得电子的还原反应,2H++2e-═H 2↑,阳极亚铁离子发生失电子的氧化反应:Fe2+-e-=Fe3+;
故答案为:Fe2+-e-=Fe3+;
①FeCl3得到循环利用,故答案为:FeCl3得到循环利用.
②电解后阳极区离子为Sn2-,酸性条件下,Sn2-和氢离子反应生成S单质,S元素失电子发生氧化反应生成S单质,同时S元素得电子生成H2S,反应方程式为Sn2-+2H+=(n-1)S↓+H2S↑,故答案为:Sn2-+2H+=(n-1)S↓+H2S↑;
ⅡH2S具有强还原性,Fe3+具有较强的氧化性,可以将S2-氧化成S单质,本身被还原成Fe2+,由于H2S是弱电解质,故书写离子方程式时,应写其分子式,即2Fe3++H2S═S↓+2Fe2++2H+,故答案为:2Fe3++H2S═S↓+2Fe2++2H+;
电解氯化亚铁时,阴极发生氢离子得电子的还原反应,2H++2e-═H 2↑,阳极亚铁离子发生失电子的氧化反应:Fe2+-e-=Fe3+;
故答案为:Fe2+-e-=Fe3+;
①FeCl3得到循环利用,故答案为:FeCl3得到循环利用.
点评:本题以S为载体考查了可逆反应、氧化还原反应、电解原理等知识点,本题是一道综合题,难度中等,考查了学生运用知识解决问题的能力,涉及到的知识点较多.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
某金属氯化物MCl240.5g,含有0.600molCl-,则金属M的摩尔质量为( )
| A、135 |
| B、64g?mol-1 |
| C、64 |
| D、135g?mol-1 |
某温度下,在容积固定的密闭容器中发生可逆反应A(g)十2B(g)?2Q(g)平衡时,各物质的浓度比为c(A):c(B):c(Q)=1:1:2,保持温度不变,以1:1:2的体积比再充人A、B、Q,则下列叙述不正确的是( )
| A、刚充入时反应速率v(正)增大,v(逆)增大 |
| B、达到新的平衡时,反应混合物中A、B的体积分数减小 |
| C、充入A、B、Q后,体系压强先增大,后逐渐减小 |
| D、若B为有色物质,达到新平衡后混合气颜色比原平衡浅 |
实验室制取Al(OH)3可选用的方法是( )
| A、铝和氢氧化钠反应 |
| B、氯化铝溶液中滴加足量氢氧化钠溶液 |
| C、向NaAlO2溶液中通入过量的CO2气体 |
| D、氯化铝溶液中滴加足量的氨水 |
下列实验过程中产生的现象与对应的图形正确的是( )
A、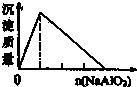 盐酸中加入NaAlO2溶液 |
B、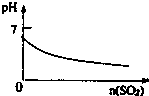 SO2气体通入溴水中 |
C、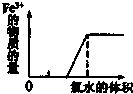 在FeBr2溶液中滴加氯水 |
D、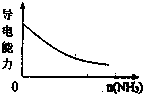 氨气通入醋酸溶液中 |
下列化合物中同分异构体数目最少的是( )
| A、戊烷 | B、戊醇 |
| C、戊烯 | D、一氯戊烷 |