题目内容
下列实验过程中产生的现象与对应的图形正确的是( )
A、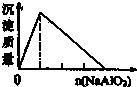 盐酸中加入NaAlO2溶液 |
B、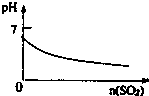 SO2气体通入溴水中 |
C、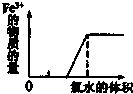 在FeBr2溶液中滴加氯水 |
D、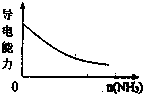 氨气通入醋酸溶液中 |
考点:镁、铝的重要化合物,电解质溶液的导电性,氯气的化学性质,二氧化硫的化学性质,铁盐和亚铁盐的相互转变
专题:图示题
分析:A、根据反应AlO2-+4H+═Al3++2H2O,Al3++3AlO2-+6H2O═4Al(OH)3↓判断;
B、根据反应Br2+SO2+2H2O═H2SO4+2HBr判断;
C、在FeBr2溶液中通入Cl2时,Cl2优先氧化Fe2+生成三价铁,再氧化Br-;
D、氨气与醋酸反应生成强电解质醋酸铵.
B、根据反应Br2+SO2+2H2O═H2SO4+2HBr判断;
C、在FeBr2溶液中通入Cl2时,Cl2优先氧化Fe2+生成三价铁,再氧化Br-;
D、氨气与醋酸反应生成强电解质醋酸铵.
解答:
解:A、在盐酸溶液中加入NaAlO2,发生反应分别为AlO2-+4H+═Al3++2H2O,Al3++3AlO2-+6H2O═4Al(OH)3↓,反应开始时没有沉淀生成,故A错误;
B、SO2气体通入溴水中,发生反应Br2+SO2+2H2O═H2SO4+2HBr,反应后溶液酸性增强,pH减小,故B正确;
C、在FeBr2溶液中通入Cl2时,Cl2优先氧化Fe2+生成三价铁,再氧化Br-,故一开始就应该生成三价铁,故C错误;
D、氨气通入醋酸溶液中,反应生成强电解质醋酸铵,溶液导电能力增强,故D错误.
故选B.
B、SO2气体通入溴水中,发生反应Br2+SO2+2H2O═H2SO4+2HBr,反应后溶液酸性增强,pH减小,故B正确;
C、在FeBr2溶液中通入Cl2时,Cl2优先氧化Fe2+生成三价铁,再氧化Br-,故一开始就应该生成三价铁,故C错误;
D、氨气通入醋酸溶液中,反应生成强电解质醋酸铵,溶液导电能力增强,故D错误.
故选B.
点评:本题考查较为综合,涉及物质的性质和弱电解质的电离,题目难度中等,并注意反应与图象的关系来解答.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
下列物质中属于纯净物的是( )
| A、液氨 | B、漂白粉 | C、氯水 | D、盐酸 |
下列物质中含有自由移动的Cl-的是( )
| A、KClO3溶液 |
| B、KCl溶液 |
| C、氯气(Cl2) |
| D、NaCl固体 |
Al2O3
AlCl3
Al(OH)3在以Al2O3为原料制备Al(OH)3时,X适宜用的试剂是( )
| HCl |
| X |
| A、NH3?H2O |
| B、CO2 |
| C、NaOH |
| D、HCl |
明矾可以净水是因为( )
| A、明矾在水中能电离出SO42- |
| B、明矾中含有多种阳离子 |
| C、明矾溶于水后可以生成Al(OH)3胶体 |
| D、明矾可以与碱反应生成Al(OH)3沉淀 |
下列仪器常用于物质分离的是( )

| A、①④⑤ | B、②④⑤ |
| C、②③⑤ | D、①③⑤ |
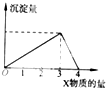 将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )
将X气体(或溶液)慢慢通入(或加人)一定量的Y溶液中,产生沉淀量与加入X的物质的量(mol)的关系如图所示,符合如图情况的是( )| A、X为NaOH溶液,Y为AlCl3溶液 |
| B、X为CO2,Y为Ca(OH)2溶液 |
| C、X为NH3,Y为AlCl3溶液 |
| D、X为HCl溶液,Y为Na[Al(OH)4]溶液 |
在强酸性条件下能大量共存的无色透明溶液是( )
| A、Fe3+、K+、Cl-、NO3- |
| B、Ba2+、Cl-、NH4+、HCO3- |
| C、Ag+、Na+、NO3-、Cl- |
| D、Al3+、SO42-、Cl-、Na+ |
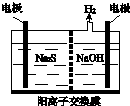 Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.
Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.