题目内容
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
称取粗盐
滤液
粗盐
(1)判断BaCl2已过量的方法是 .
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2) .
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是 .
称取粗盐
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
(1)判断BaCl2已过量的方法是
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
考点:粗盐提纯
专题:实验设计题
分析:(1)BaCl2已过量时,溶液中会有剩余的钡离子,可以通过检验钡离子来确定氯化钡是否过量;
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子;
(3)Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成氯化镁、氯化钙、氯化钡等物质,会影响制得精盐的纯度.
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子;
(3)Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成氯化镁、氯化钙、氯化钡等物质,会影响制得精盐的纯度.
解答:
解:(1)BaCl2已过量时,溶液中会有剩余的钡离子,可以通过检验钡离子来确定氯化钡是否过量,所以取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,表明BaCl2已过量;
故答案为:继续滴加氯化钡溶液不再出现沉淀;
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl;
故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl;
(3)若先用盐酸调pH再过滤,那样Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成易溶于水的氯化镁、氯化钙、氯化钡等物质,从而影响氯化钠的纯度.
故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度.
故答案为:继续滴加氯化钡溶液不再出现沉淀;
(2)粗盐的提纯中,加入碳酸钠的作用是除去杂质离子钙离子以及过量的钡离子,反应的化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl;
故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl;
(3)若先用盐酸调pH再过滤,那样Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成易溶于水的氯化镁、氯化钙、氯化钡等物质,从而影响氯化钠的纯度.
故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度.
点评:本题考查了有关粗盐的提纯知识,可以根据所学知识进行回答,除杂时前面加入的试剂必须在后面除去,题目难度不大.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、32 g O2分子和32 g O3分子所含的氧原子数目相等 |
下列物质中含有自由移动的Cl-的是( )
| A、KClO3溶液 |
| B、KCl溶液 |
| C、氯气(Cl2) |
| D、NaCl固体 |
铁铝矾[Al2Fe(SO4)4?XH2O]有净水作用,将其溶于水中得到浅绿色溶液,有关溶液的叙述正确的是( )
| A、该溶液呈中性 |
| B、该溶液中:2c(Al3+)+c(Fe2+)+c(H+)=4c(SO42-)+c(OH-) |
| C、在空气中蒸干并灼烧该溶液,最后所得残留固体为氧化铝和氧化铁 |
| D、向该溶液中加入氢氧化钡溶液,当SO42-完全沉淀是,Al3+、Fe2+恰好被完全沉淀 |
Al2O3
AlCl3
Al(OH)3在以Al2O3为原料制备Al(OH)3时,X适宜用的试剂是( )
| HCl |
| X |
| A、NH3?H2O |
| B、CO2 |
| C、NaOH |
| D、HCl |
下列仪器常用于物质分离的是( )
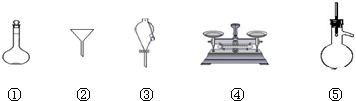

| A、①④⑤ | B、②④⑤ |
| C、②③⑤ | D、①③⑤ |
生产、生活离不开各种化学物质,下列说法不正确的是( )
| A、氧化铝可以用来制造耐火坩埚、耐火管和耐高温的实验仪器 |
| B、氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| C、氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 |
| D、氨气溶于水显碱性,可以用湿润的红色石蕊试纸检验氨气的生成 |
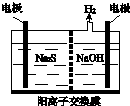 Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.
Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.