题目内容
表为长式周期表的一部分,其中的编号代表对应的元素.请回答下列问题:
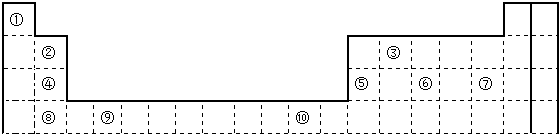
(1)表中属于d区元素的是 (填元素符号).
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为 ;③和⑦形成的一种常见溶剂的化学式为 ,其立体构型为 .
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为 ;该元素与元素①所形成化合物的水溶液显 性(填“酸”或“碱”).
(4)元素④的第一电离能 元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性 元素⑦(选填“>”、“=”、“<”)的电负性.
(5)元素⑦和⑧形成的化合物的电子式为 .
(6)元素⑩的基态原子核外电子排布式是 .

(1)表中属于d区元素的是
(2)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为
(3)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为
(4)元素④的第一电离能
(5)元素⑦和⑧形成的化合物的电子式为
(6)元素⑩的基态原子核外电子排布式是
考点:元素周期律和元素周期表的综合应用
专题:
分析:根据元素周期表中元素的分布,知道①是H,②是Be,③是C,④是Mg,⑤是Al,⑥是P,⑦是Cl,⑧是Ca,⑨是Ti,⑩是Cu.
(1)根据d区元素所包含的族来回答;
(2)根据苯、四氯化碳的原子构成以及空间结构来回答;
(3)电子排布式为nsnnpn+1,即n=2,所以为:2s22p3,所以该元素原子的最外电子层上电子数是5,据此回答;
(4)越容易失去一个电子的第一电离能越小,越容易得电子的电负性越大;
(5)氯化钙是离子化合物,根据电子式的书写来回答;
(6)根据Cu的基态核外电子排布情况来回答.
(1)根据d区元素所包含的族来回答;
(2)根据苯、四氯化碳的原子构成以及空间结构来回答;
(3)电子排布式为nsnnpn+1,即n=2,所以为:2s22p3,所以该元素原子的最外电子层上电子数是5,据此回答;
(4)越容易失去一个电子的第一电离能越小,越容易得电子的电负性越大;
(5)氯化钙是离子化合物,根据电子式的书写来回答;
(6)根据Cu的基态核外电子排布情况来回答.
解答:
解:根据元素周期表中元素的分布,知道①是H,②是Be,③是C,④是Mg,⑤是Al,⑥是P,⑦是Cl,⑧是Ca,⑨是Ti,⑩是Cu.
(1)表中属于d区元素的是Ti,故答案为:Ti;
(2)表中元素H的6个原子与元素C的6个原子形成的某种环状分子名称为苯,C和Cl形成的一种常见溶剂的化学式为CCl4,其立体构型为正四面体,
故答案为:苯、CCl4、正四面体;
(3)根据原子的外围电子排布式的特点,该电子排布式为nsnnpn+1,即n=2,所以为:2s22p3,该元素原子的最外电子层上电子数是5,其孤电子对数为1,即为N元素,它和氢元素形成的化合物是氨气,其水溶液显碱性,故答案为:1;碱;
(4)④是Mg,⑤是Al,其中Al更易失最外层的一个电子,但是Mg的最外层是成对电子,不易失掉1个电子,故第一电离能Mg>Al,⑥是P,⑦是Cl,Cl的最外层是7个电子,更易得到一个电子,所以电负性是Cl>P,故答案为:>;<;
(5)Cl和Ca形成的化合物氯化钙是离子化合物,电子式为: ,故答案为:
,故答案为: ;
;
(6)元素⑩为Cu,核外电子是29个,它的基态原子核外电子排布式是:1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1.
(1)表中属于d区元素的是Ti,故答案为:Ti;
(2)表中元素H的6个原子与元素C的6个原子形成的某种环状分子名称为苯,C和Cl形成的一种常见溶剂的化学式为CCl4,其立体构型为正四面体,
故答案为:苯、CCl4、正四面体;
(3)根据原子的外围电子排布式的特点,该电子排布式为nsnnpn+1,即n=2,所以为:2s22p3,该元素原子的最外电子层上电子数是5,其孤电子对数为1,即为N元素,它和氢元素形成的化合物是氨气,其水溶液显碱性,故答案为:1;碱;
(4)④是Mg,⑤是Al,其中Al更易失最外层的一个电子,但是Mg的最外层是成对电子,不易失掉1个电子,故第一电离能Mg>Al,⑥是P,⑦是Cl,Cl的最外层是7个电子,更易得到一个电子,所以电负性是Cl>P,故答案为:>;<;
(5)Cl和Ca形成的化合物氯化钙是离子化合物,电子式为:
 ,故答案为:
,故答案为: ;
;(6)元素⑩为Cu,核外电子是29个,它的基态原子核外电子排布式是:1s22s22p63s23p63d104s1或[Ar]3d104s1,
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1.
点评:本题综合考查学生元素周期表的结构和元素周期律的知识,注意知识的迁移和应用是关键,难度不大.

练习册系列答案
相关题目
根据下列反应的化学方程式:①Zn+CuSO4=ZnSO4+Cu、②Cu+2AgNO3=Cu(NO3)2+2Ag,判断三种金属的氧化性强弱顺序是( )
| A、Zn2+>Cu2+>Ag+ |
| B、Zn2+>Ag+>Cu2+ |
| C、Cu2+>Ag+>Zn2+ |
| D、Ag+>Cu2+>Zn2+ |
下列有关铝化合物说法正确的是( )
| A、氧化铝的熔点很高,所以不可以用来冶炼铝 |
| B、氢氧化铝可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,所以明矾可用作净水剂 |
| C、实验室可以用过量氢氧化钠与氯化铝来制备氢氧化铝 |
| D、氢氧化铝既可与酸反应又可与碱反应,是两性氢氧化物 |
下列物质中含有自由移动的Cl-的是( )
| A、KClO3溶液 |
| B、KCl溶液 |
| C、氯气(Cl2) |
| D、NaCl固体 |
明矾可以净水是因为( )
| A、明矾在水中能电离出SO42- |
| B、明矾中含有多种阳离子 |
| C、明矾溶于水后可以生成Al(OH)3胶体 |
| D、明矾可以与碱反应生成Al(OH)3沉淀 |
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、明矾水解生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、高温电解Al2O3可制得金属铝 |
| C、MgO的熔点很高,可用于制作耐高温材料 |
| D、根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应 |
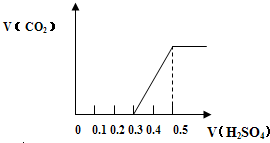 分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令
分别称取质量为m1g的NaHCO3和NaOH的固体混合物样品两份,置于密闭容器中,在300℃条件下充分加热,排尽气体后,测得剩余固体质量为 m2g.小林和小芳两同学对加热后的剩余固体进行研究.为研究方便,令
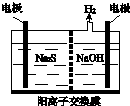 Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.
Ⅰ硫化氢的转化是资源利用和环境保护的重要研究课题.由硫化氢获得硫单质有多种方法.