题目内容
1000℃时,在密闭容器中加入一定量的Na2SO4固体使其发生以下反应并达平衡:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),△H<0,在恒温恒容时回答以下问题:
(1)向容器中分别加入以下物质,判断对平衡有无影响,有影响的应填写出平衡移动的方向.
①加入Na2SO4 .②加入焦炭 .
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,Na2SO4的转化率是 .
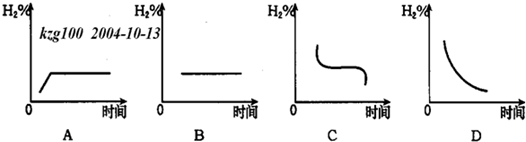
(3)若将容器温度升高20℃,H2在混合气体中含量变化用图中 图表示最合适.
(1)向容器中分别加入以下物质,判断对平衡有无影响,有影响的应填写出平衡移动的方向.
①加入Na2SO4
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,Na2SO4的转化率是
(3)若将容器温度升高20℃,H2在混合气体中含量变化用图中

考点:化学平衡的影响因素,化学平衡的计算
专题:化学平衡专题
分析:(1)①固体不影响化学平衡;
②加入焦炭和平衡状态水蒸气反应,平衡正向进行;
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,依据反应前后固体质量变化计算反应的硫酸钠,Na2SO4的转化率=
×100%;
(3)反应是放热反应,升温平衡正向进行,最后达到平衡氢气含量增加后不变,据此分析判断;
②加入焦炭和平衡状态水蒸气反应,平衡正向进行;
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,依据反应前后固体质量变化计算反应的硫酸钠,Na2SO4的转化率=
| 反应的量 |
| 起始量 |
(3)反应是放热反应,升温平衡正向进行,最后达到平衡氢气含量增加后不变,据此分析判断;
解答:
(1)①Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),△H<0,硫酸钠为固体,加入Na2SO4,不影响化学平衡;
故答案为:无;
②加入焦炭1000℃时,和水蒸气发生反应,平衡正向进行;
故答案为:正向移动;
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,反应前后固体质量减小=1.42g-1.10g=0.32g,依据质量变化计算反应的硫酸钠质量为x
Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),△m
142 64g
x 0.32g
x=0.71g
Na2SO4的转化率=
×100%=50%
故答案为:50%;
(3)反应是放热反应,升温20°C,平衡正向进行,氢气含量先增加,达到平衡状态后不变,故选A.
故答案为:A.
故答案为:无;
②加入焦炭1000℃时,和水蒸气发生反应,平衡正向进行;
故答案为:正向移动;
(2)若初时加入的Na2SO4是1.42g,平衡时容器中固体物质质量是1.10g,反应前后固体质量减小=1.42g-1.10g=0.32g,依据质量变化计算反应的硫酸钠质量为x
Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g),△m
142 64g
x 0.32g
x=0.71g
Na2SO4的转化率=
| 0.71g |
| 1.42g |
故答案为:50%;
(3)反应是放热反应,升温20°C,平衡正向进行,氢气含量先增加,达到平衡状态后不变,故选A.
故答案为:A.
点评:本题考查了影响化学平衡因素分析判断,化学方程式计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
下列化合物的分子中,所有原子都处于同一平面的有( )
| A、乙烷 | B、甲苯 | C、氟苯 | D、乙醛 |
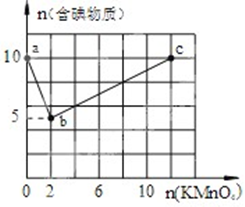 实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.
实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+. ②
② ③
③ ④
④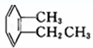 ⑤
⑤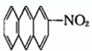
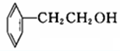 ⑦
⑦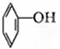 ⑧CH3CH=CH-COOH⑨
⑧CH3CH=CH-COOH⑨
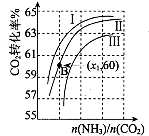 用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g).工业生产时,原料气带有水蒸气.图表示CO2的转化率与氨碳比
用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g).工业生产时,原料气带有水蒸气.图表示CO2的转化率与氨碳比