题目内容
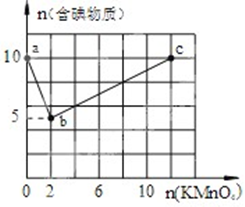 实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.
实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.(1)a→b过程中,被氧化的元素为
(2)写出b→c过程的离子反应方程式
实验二:向KI和硫酸混合溶液中加入过氧化氢溶液,迅速反应放出大量气泡,溶液呈棕色.
查阅资料知,反应过程如下:①H2O2+2KI+H2SO4→I2+K2SO4+2H2O;②H2O2+I2→2HIO;③H2O2+2HIO→I2+O2↑+2H2O
(3)上述实验过程中,I2起到了
(4)试判断,酸性条件下HIO、H2O2、O2三种物质氧化性的强弱
考点:化学方程式的有关计算
专题:计算题
分析:(1)b点时,KI反应完全,n(KI)=10mol、n(KMnO4)=2mol,反应中KI中I元素被氧化,结合Mn元素化合价变化计算转移电子物质的量,再根据电子转移守恒计算I元素在氧化产物中的化合价,确定b点生成的含碘物质;
(2)b→c过程中消耗n(KMnO4)=12mol-2mol=10mol,I元素物质的量不变,根据电子转移守恒计算I元素在氧化产物中的化合价,确定氧化产物,配书写离子方程式;
(3)反应过程中,I2参与反应,最终又生成等量的I2,加快过氧化氢的分解,I2起催化剂作用;
(4)氧化性:氧化剂>氧化产物;
(2)b→c过程中消耗n(KMnO4)=12mol-2mol=10mol,I元素物质的量不变,根据电子转移守恒计算I元素在氧化产物中的化合价,确定氧化产物,配书写离子方程式;
(3)反应过程中,I2参与反应,最终又生成等量的I2,加快过氧化氢的分解,I2起催化剂作用;
(4)氧化性:氧化剂>氧化产物;
解答:
解:(1)b点时,KI反应完全,n(KI)=10mol、n(KMnO4)=2mol,反应中KI中I元素被氧化,
Mn元素化合价由+7价降低为+2,转移电子物质的量=2mol×(7-2)=10mol,令I元素在氧化产物中的化合价为a,根据电子转移守恒,则10[a-(-1)]=10,解得a=0,故b点生成的含碘物质为I2,
故答案为:I;I2;10;
(2)b→c过程中消耗n(KMnO4)=12mol-2mol=10mol,I元素物质的量不变,令I元素在氧化产物中的化合价为b,根据电子转移守恒:10(b-0)=10×(7-2),解得b=5,氧化产物为10mol,故为IO3-,配平后反应离子方程式为:2MnO4-+I2+4H+=2Mn2++2IO3-+2H2O,
故答案为:2MnO4-+I2+4H+=2Mn2++2IO3-+2H2O;
(3)反应过程中,I2参与反应,最终又生成等量的I2,加快过氧化氢的分解,I2起催化剂作用,
故答案为:催化剂;
(4)由②H2O2+I2→2HIO,可知氧化性:H2O2>HIO,由③H2O2+2HIO→I2+O2↑+2H2O,可知氧化性:HIO>O2,故氧化性:H2O2>HIO>O2,
故答案为:H2O2>HIO>O2.
Mn元素化合价由+7价降低为+2,转移电子物质的量=2mol×(7-2)=10mol,令I元素在氧化产物中的化合价为a,根据电子转移守恒,则10[a-(-1)]=10,解得a=0,故b点生成的含碘物质为I2,
故答案为:I;I2;10;
(2)b→c过程中消耗n(KMnO4)=12mol-2mol=10mol,I元素物质的量不变,令I元素在氧化产物中的化合价为b,根据电子转移守恒:10(b-0)=10×(7-2),解得b=5,氧化产物为10mol,故为IO3-,配平后反应离子方程式为:2MnO4-+I2+4H+=2Mn2++2IO3-+2H2O,
故答案为:2MnO4-+I2+4H+=2Mn2++2IO3-+2H2O;
(3)反应过程中,I2参与反应,最终又生成等量的I2,加快过氧化氢的分解,I2起催化剂作用,
故答案为:催化剂;
(4)由②H2O2+I2→2HIO,可知氧化性:H2O2>HIO,由③H2O2+2HIO→I2+O2↑+2H2O,可知氧化性:HIO>O2,故氧化性:H2O2>HIO>O2,
故答案为:H2O2>HIO>O2.
点评:本题综合考查氧化还原反应,侧重于考查学生的数据分析能力和综合运用化学知识的能力,题目难度中等,注意利用电子转移守恒的反应产物.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
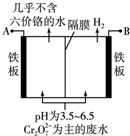 某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )
某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,工业设备如图所示,下列说法正确的是( )| A、A接电源负极 |
| B、阳极区溶液中发生的氧化还原反应为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
| C、阴极区附近溶液pH降低 |
| D、若不考虑气体的溶解,当收集到H213.44L(标准状况)时,有0.2mol Cr2O72-被还原 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、能使甲基橙变黄的溶液中:Na+、K+、SO42-、AlO2- |
| B、水电离产生的c(H+)=1×10-12mol/L溶液:CH3COOH、Na+、Cl-、I- |
| C、能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32- |
| D、0.1 mol?L-1NaHCO3溶液中:K+、Ba2+、OH-、Cl- |