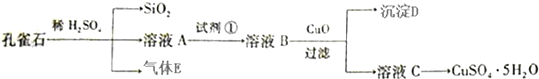
题目内容
11.下列离子中外层d轨道达半充满状态的是( )| A. | 24Cr3+ | B. | 26Fe3+ | C. | 27Co3+ | D. | 29Cu+ |
分析 3d轨道半充满说明3d轨道中含有5个电子,即为3d5,写出离子的价电子排布式进行判断.
解答 解:A.24Cr电子排布式为1s22s22p63s23p63d54s1,Cr3+的价电子排布式为3d3,d轨道不是半充满状态,故A错误;
B.Fe元素为26号元素,原子核外有26个电子,分四层排布,所以核外电子排布式为:1s22s22p63s23p63d64s2,Fe3+的价电子排布式为3d5,d轨道达半充满状态,故B正确;
C.Co元素为27号元素,原子核外有27个电子,分四层排布,所以核外电子排布式为:1s22s22p63s23p63d74s2,Co3+的价电子排布式为3d6,d轨道不是半充满状态,故C错误;
D.Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,Cu+的价电子排布式为3d10,d轨道处于全满状态,故D错误;
故选B.
点评 本题考查了元素核外电子排布,明确电子排布规则中的构造原理是解本题关键,注意第四周期元素核外电子排布的书写,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.下列除去杂质的方法正确的是( )
①除去乙醇中少量的乙醛:加入新制的氢氧化铜浊液,加热至沸腾,过滤取溶液
②除去福尔马林中少量的蚁酸:加入足量饱和碳酸钠溶液,充分振荡、蒸馏,收集馏出物
③除去苯中少量的苯酚:加溴水,振荡,过滤除去沉淀
④除去乙醇中少量的水:加足量新制生石灰,蒸馏.
①除去乙醇中少量的乙醛:加入新制的氢氧化铜浊液,加热至沸腾,过滤取溶液
②除去福尔马林中少量的蚁酸:加入足量饱和碳酸钠溶液,充分振荡、蒸馏,收集馏出物
③除去苯中少量的苯酚:加溴水,振荡,过滤除去沉淀
④除去乙醇中少量的水:加足量新制生石灰,蒸馏.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
19.下列装置进行有关实验不能达到预期目的是( )

| A. | 若图Ⅰ所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 | |
| B. | 用图2装置可测定过氧化氢分解反应产生气体体积(液体体积忽略) | |
| C. | 用图3装置制备金属锰 | |
| D. | 用图4装置可验证化学能转化为电能 |
6.2005年11月18日国际著名血液学杂志《BLOOD》刊载了一条令人振奋的科研成果,中国科学家找到白血病的致病元凶--蛋白质Shp-2.下列关于蛋白质Shp-2说法正确的是( )
| A. | 它是高分子化合物 | |
| B. | 天然蛋白质仅由碳、氢、氧、氮四种元素组成 | |
| C. | 在一定条件下能水解最终生成多肽 | |
| D. | 氨基酸和蛋白质Shp-2都只能与碱反应 |
11.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 常温常压下,17 g甲基(-14CH3)所含的中子数为8NA | |
| B. | 0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.2NA | |
| C. | 标准状况下,44.8 L NO与22.4 L O2混合后气体的分子总数为2NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
 一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象:
一定温度下,在一容积不变的容器中,发生化学反应aA(g)+bB(g)═cC(g),采用不同比例的A,B作为起始物,测量反应达平衡时A和B的转化率,得到如图图象: