题目内容
11.设NA为阿伏加德罗常数的值,下列叙述不正确的是( )| A. | 常温常压下,17 g甲基(-14CH3)所含的中子数为8NA | |
| B. | 0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.2NA | |
| C. | 标准状况下,44.8 L NO与22.4 L O2混合后气体的分子总数为2NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
分析 A、求出甲基-14CH3的物质的量,然后根据1mol甲基-14CH3中含8mol中子来分析;
B、0.1mol铁和0.1mol氯气反应时,铁过量,根据氯气反应后变为-1价来分析;
C、NO和氧气反应后生成NO2,NO2中存在平衡:2NO2?N2O4;
D、氧化钠和过氧化钠均由2个钠离子和1个阴离子构成.
解答 解:A、17g甲基-14CH3的物质的量为1mol,而1mol甲基-14CH3中含8mol中子,即含8NA个,故A正确;
B、0.1mol铁和0.1mol氯气反应时,铁过量,而氯气反应后变为-1价,故0.1mol氯气转移0.2NA个电子,故B正确;
C、标准状况下,44.8 L NO与22.4 L O2混反应后生成2molNO2,但NO2中存在平衡:2NO2?N2O4,故反应后混合物的分子总数小于2NA个,故C错误;
D、氧化钠和过氧化钠均由2个钠离子和1个阴离子构成,故1mol氧化钠和过氧化钠的混合物中含阴阳离子总数为3NA个,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
11.下列离子中外层d轨道达半充满状态的是( )
| A. | 24Cr3+ | B. | 26Fe3+ | C. | 27Co3+ | D. | 29Cu+ |
2. 某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )
某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )
 某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )
某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )| A. | $\root{3}{\frac{2a}{{N}_{AP}}}$ | B. | $\sqrt{3}$•$\root{3}{\frac{2a}{{N}_{AP}}}$ | C. | $\frac{\sqrt{3}}{4}$×3$\sqrt{\frac{2a}{{N}_{AP}}}$•3 | D. | $\frac{1}{2}$•3$\sqrt{\frac{2a}{{N}_{AP}}}$ |
19.下列有机物命名正确的是( )
| A. | 2-乙基丙烷  | B. | CH3CH2CH2CH2OH 1-丁醇 | ||
| C. | 间二甲苯  | D. | 2-甲基-2-丙烯 |
16.为鉴别乙醇、乙酸、葡萄糖溶液,选用一种试剂,可为下列中的( )
| A. | 氢氧化钠 | B. | 硝酸 | C. | 碘 | D. | 新制氢氧化铜 |
3.在固定体积的密闭容器中进行下列反应:A(s)+2B(g)?C(g)+D(g)恒温下,当下列物理量不再变化时,表明上述反应已达平衡的是( )
| A. | 混合气体的压强 | B. | 混合气体的密度 | ||
| C. | A的物质的量浓度 | D. | 反应速度:VB(正)=VC(逆) |
1.最近中美科学家首次研获单层硼原子构成的“硼烯”(如图),有关“硼烯”的说法正确的是( )
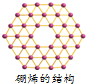

| A. | 是一种新型化合物 | B. | 与金刚石结构相似 | ||
| C. | 与${\;}_{5}^{10}$B互为同素异形体 | D. | 由共价键构成的单质 |