题目内容
2.标准状况下,1mol气体的体积是22.4L,如果当1mol气体的体积是22.4L时,一定是标准状况吗?分析 气体分子间距远远大于分子本身的大小,本身大小可以忽略,影响气体体积的因素有分子间距、气体分子数目,一定温度压强下,气体分子间距相等,故相同分子数目的气体占有的体积相同,标准状况下,气体摩尔体积为22.4L/mol,1mol气体的体积约是22.4L,在非标准状况下,气体摩尔体积也可能是22.4L/mol,所以当1mol气体的体积是22.4L时,不一定是标准状况.
解答 解:标准状况下,气体摩尔体积为22.4L/mol,1mol气体占有的体积约是22.4L,如果当1mol气体的体积是22.4L时,依据PV=nRT,温度和压强同倍数变化,满足条件的T、P很多,气体体积可以1mol是22.4L,但气体不一定处于标准状况,
答:当1mol气体的体积是22.4L时,不一定是标准状况.
点评 本题考查气体摩尔体积,题目难度不大,可借助PV=nRT理解,注意非标准状况下,气体摩尔体积也可能是22.4L/mol,注意理解影响气体体积的因素.

练习册系列答案
相关题目
12. 将植物秸秆、枝叶、杂草和人畜粪便加入沼气发酵池(如图),在沼气细菌作用下可产生沼气(主要成分是CH4,还含有CO2及少量的H2S、NH3等).下列说法不正确的是( )
将植物秸秆、枝叶、杂草和人畜粪便加入沼气发酵池(如图),在沼气细菌作用下可产生沼气(主要成分是CH4,还含有CO2及少量的H2S、NH3等).下列说法不正确的是( )
 将植物秸秆、枝叶、杂草和人畜粪便加入沼气发酵池(如图),在沼气细菌作用下可产生沼气(主要成分是CH4,还含有CO2及少量的H2S、NH3等).下列说法不正确的是( )
将植物秸秆、枝叶、杂草和人畜粪便加入沼气发酵池(如图),在沼气细菌作用下可产生沼气(主要成分是CH4,还含有CO2及少量的H2S、NH3等).下列说法不正确的是( )| A. | 沼气是一种生物质能 | |
| B. | 沼气中的NH3、H2S来自植物中纤维素发酵产生 | |
| C. | 控制厌氧、适宜的温度等条件有利于CH4的产生 | |
| D. | 从沼气池出料口获得的发酵残留物可用作肥料 |
13.如图是元素周期表的一部分,下列说法正确的是( )


| A. | 离子半径:W->X+>Y3- | |
| B. | 可在灰色区域“甲”中寻找催化剂 | |
| C. | 气态氢化物的稳定性:Z>W | |
| D. | 工业上电解 X和 W化合物的水溶液制备 X |
10.下列反应属于取代反应的是( )
| A. | 乙烯和酸性高锰酸钾溶液的反应 | |
| B. | 在一定条件下,乙烯和水的反应 | |
| C. | 在FeBr3催化作用下,苯和溴的反应 | |
| D. | 在镍作催化剂、加热的条件下,苯和氢气的反应 |
7.下列排序不正确的是( )
| A. | 单质的熔点:钾<铷<铯 | B. | 离子半径:S2->Na+>Mg2+ | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:H2SiO3<H3PO4<H2SO4 |
14.下列说法正确的是( )
| A. | 蔗糖加稀硫酸水解后,加入新制氢氧化铜溶液,煮沸,可以检验产物是否含有葡萄糖 | |
| B. | 钠可保存在煤油中,而钠可与乙醇发生反应,可说明乙醇分子含有羟基的氢原子 | |
| C. | 可用溴水鉴别乙醇、己烷、硝基苯、乙酸 | |
| D. | 乙酸乙酯和乙醇可用分液的方式分离 |
11.下列离子中外层d轨道达半充满状态的是( )
| A. | 24Cr3+ | B. | 26Fe3+ | C. | 27Co3+ | D. | 29Cu+ |
2.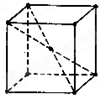 某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )
某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )
 某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )
某晶体为体心立方晶格(如图),实验测得其密度为ρ(g•cm-3).已知它的相对原子质量为a,阿伏加德罗常数为NA(mol-1),假定晶体中原子为等径的刚性球且处于体对角性上的三个球相切.则该晶体晶胞的边长(cm)为( )| A. | $\root{3}{\frac{2a}{{N}_{AP}}}$ | B. | $\sqrt{3}$•$\root{3}{\frac{2a}{{N}_{AP}}}$ | C. | $\frac{\sqrt{3}}{4}$×3$\sqrt{\frac{2a}{{N}_{AP}}}$•3 | D. | $\frac{1}{2}$•3$\sqrt{\frac{2a}{{N}_{AP}}}$ |
