题目内容
18.工业上以黄铜矿(主要成分CuFeS2,铁为+2 价)为原料制备铜的工艺常有两种.回答下列问题:(1)火法熔炼工艺.该工艺经过浮选、焙烧、熔炼等程度,在使铁元素及其他有关杂质进入炉渣的同时,使铜元素还原为粗铜,发生的主要反应为:
2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ.mol-1
2Cu2S(s)+Cu2S(s)═6Cu(s)+SO2(g)△H=+116.0kJ.mol-1
①“火法熔炼工艺”中的“焙烧”程序,是在通入少量空气的情况下使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S 和FeS)和SO2,该反应的化学方程式为2CuFeS2+O2$\frac{\underline{\;高温\;}}{\;}$Cu2S(s)+2FeS+SO2.
②为加快黄铜矿焙烧速率,可采取的措施有将黄铜矿粉碎、升高温度、增大空气流速(写1种).
③在“火法熔炼工艺”中,Cu2S 与等物质的量的O2 反应生成Cu 的热化学方程式为Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.4kJ•mol-1 .
下列处理SO2的方法,合理的是bc(填选项).
a.将反应炉建高,采取高空排放 b.用纯碱溶液吸收制备亚硫酸钠
c.用氨水吸收后,再经氧化制备硫酸铵 d.用BaCl2 溶液吸收制备BaSO3
(2)FeCl3 溶液浸出工艺.该工艺的主要流程为::
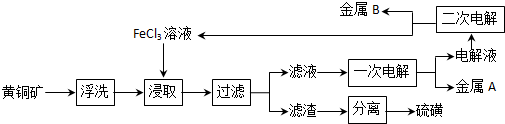
如果只考虑黄铜矿中CuFeS2 参与反应,则“浸出”后的“滤液”中仅含两种金属阳离子,而且最终FeCl3 溶液能全部获得再生以供循环使用.
①在“FeCl3溶液浸出工艺”中,“浸出”反应的离子方程式为CuFeS2+4Fe3+═Cu2++5Fe2+2S.
②已知“FeCl3溶液浸出工艺”的两次电解(阳极均为惰性材料)都需要使用阴离子交换膜,其中“一次电解”的两极反应式分别为:阳极Fe2+-e-═Fe3+;阴极Cu2++2e-═Cu.
③当一次电解与二次电解正好完成时,两次电解过程通过电路的电子数相等,则理论上所得金属A与金属B 的物质的量之比为1:1.
分析 (1)①根据信息确定化学反应的反应物和生成物,进而书写化学方程式;
②根据影响化学反应速率的外界因素可知,提高温度、增大反应物浓度、增大反应物接触面积等,都可以提高反应速率;
③利用盖斯定律来计算化学反应的焓变;SO2是酸性氧化物,能与氨水、碳酸钠等物质反应,但不能与氯化钡反应,据此答题;
(2)黄铜矿(主要成分CuFeS2,铁为+2 价),只考虑黄铜矿中CuFeS2 参与反应,用氯化铁溶液浸取,得到含有Cu 2+、Fe 2+的溶液和硫沉淀,电解含有Cu 2+、Fe 2+的溶液得金属A为铜,所得电解液为FeCl2溶液,经二次电解可知金属B为铁和氯化铁溶液,FeCl3 溶液能全部获得再生以供循环使用,据此答题;
解答 解:(1)①根据信息:“焙烧”时,通入少量空气使黄铜矿部分脱硫生成焙砂(主要成分是Cu2S和FeS)和SO2,知道反应物是黄铜矿和氧气,产物是Cu2S和FeS,反应的化学方程式为:2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S(s)+2FeS+SO2,
故答案为:2CuFeS2+O2 $\frac{\underline{\;高温\;}}{\;}$Cu2S(s)+2FeS+SO2;
②根据影响化学反应速率的外界因素可知,为加快黄铜矿焙烧速率,可采取的措施有将黄铜矿粉碎、升高温度、增大空气流速,
故答案为:将黄铜矿粉碎、升高温度、增大空气流速;
③已知:A、2Cu2S(s)+3O2(g)═2Cu2O(s)+2SO2(g)△H=-768.2kJ•mol-1,B、2Cu2O(s)+Cu2S (s)═6Cu(s)+SO2(g)△H=+116.0kJ•mol-1,则Cu2S(s)+O2(g)=2Cu(s)+SO2(g)可以是$\frac{1}{3}$ (A+B),即△H=$\frac{1}{3}$×(116.0kJ•mol-1-768.2kJ•mol-1)=-217.4 kJ•mol-1,处理SO2的方法中a.将反应炉建高,采取高空排放,仍然会污染空气,故a错误;
b.用纯碱溶液吸收,二氧化硫与碳酸钠反应制备亚硫酸钠,故b正确;
c.用氨水吸收后,生成亚硫酸铵,再经氧化制备硫酸铵,故c正确;
d.二氧化硫不与用BaCl2 溶液反应,所以不能制备BaSO3,故d错误,故选bc,
故答案为:Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=-217.4 kJ•mol-1 ;bc;
(2)黄铜矿(主要成分CuFeS2,铁为+2 价),只考虑黄铜矿中CuFeS2 参与反应,用氯化铁溶液浸取,得到含有Cu 2+、Fe 2+的溶液和硫沉淀,电解含有Cu 2+、Fe 2+的溶液得金属A为铜,所得电解液为FeCl2溶液,经二次电解可知金属B为铁和氯化铁溶液,FeCl3 溶液能全部获得再生以供循环使用,
①根据上面的分析可知,在“FeCl3溶液浸出工艺”中,“浸出”反应的离子方程式为CuFeS2+4Fe3+═Cu2++5Fe2+2S,
故答案为:CuFeS2+4Fe3+═Cu2++5Fe2+2S;
②“一次电解”时,阳极上亚铁离子失电子生成铁离子,电极反应式为Fe2+-e-═Fe3+,阴极上铜离子得电子生成铜,电极反应式为Cu2++2e-═Cu,
故答案为:Fe2+-e-═Fe3+;Cu2++2e-═Cu;
③一次电解时生成铜的电极反应式为Cu2++e-═Cu,二次电解生成铁的电极反应式为Fe2++e-═Fe,两次电解过程通过电路的电子数相等,铜与铁的物质的量之比为1:1,
故答案为:1:1.
点评 本题考查了黄铜矿的加工方法,试题涉及了化学式的书写、热化学方程式的书写、物质的分离与提纯、离子方程式的书写、电化学、化学反应速率等知识,注意知识的归纳和整理是解题关键,难度中等.

| A. | 同一主族元素的原子序数的差不可能为10 | |
| B. | 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 | |
| C. | 催化剂一般在金属与非金属的分界线处寻找 | |
| D. | 过渡元素全部是金属元素 |
①FeCl2溶液 ②CuSO4溶液 ③Na2SO3溶液 ④饱和NaOH溶液 ⑤品红溶液.
| A. | ①② | B. | ①②③ | C. | ①②④ | D. | ①②③④ |

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下.
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | 9.0 | -- | -- |
| 沉淀完全时的pH | 3.7 | 9.6 | 11.0 | 8(>8溶解) | 9(>9溶解) |
(2)如果把“调pH=8”和“调pH>11”中间的“过滤”步骤省略,引起的后果是pH>11时Al(OH)3会溶解,引入杂质离子AlO2-,使产品不纯.
(3)流程图中“□”内的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)工业废水中的Na2CrO4遇酸时可转化为Na2Cr2O7,含Cr2O72-的废水毒性较大,为了使废水的排放达标,进行如下处理:

①绿矾化学式为FeSO4•7H20,反应(Ⅰ)的离子方程式为Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O.
②若处理后的废水中c(Cr3+)=3.0×10-6mol•L-1,则废水中c(Fe3+)=2×10-13mol•L-1.
(Ksp[Fe(OH)3])=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
(5)某工厂为了测定重铬酸钠样品的纯度,称取重铬酸钠试样2.500g配成250mL溶液,取出25.00mL于碘量瓶中,加入10mL 2mol•L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,再加入淀粉溶液作指示剂,用0.1200mol•L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-).
①判断达到滴定终点的依据是当滴加最后一滴硫代硫酸钠溶液时,溶液蓝色褪去,半分钟内不变色;
②若实验中共用去Na2S2O3标准溶液40.00ml,则该工厂的重铬酸钠样品的纯度为(设整个过程中其它杂质不参与反应)83.84%.
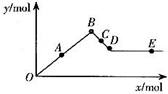 已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系.下列有关叙述正确的是( )| A. | A~D时沉淀的物质的量:Al(OH)3比BaSO4多 | |
| B. | C~D时溶液中离子的物质的量:AlO2-比Ba2+多 | |
| C. | A~D时沉淀的物质的量:BaSO4可能小于Al(OH)3 | |
| D. | D~E时溶液中离子的物质的量:Ba2+可能等于OH- |
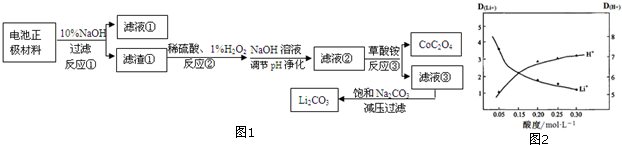
已知:ⅰ.LiCoO2是不溶于水的固体
ⅱ.25℃时,部分电解质的Ksp或Ka
| 弱电解质 | CoC2O4 | Fe(OH)3 | NH3•H2O | H2C2O4 |
| 平衡常数 | Ksp=6.3×10-8 | Ksp=2.79×10-39 | Ka=1.7×10-5 | Ka1=5.6×10-2 Ka2=5.4×10-5 |
(1)滤液①的主要成分是Na[Al(OH)4](填化学式,下同),滤液③中的阴离子除OH-外主要还含有C2O42-、SO42-.
(2)反应②中H2O2改用盐酸代替,不妥的原因是盐酸反应后会产生有毒气体Cl2同时盐酸不能氧化二价亚铁;写出反应②中钴元素化合物与H2O2反应的化学方程式2LiCoO2+3H2SO4+H2O2=2CoSO4+O2↑+Li2SO4+4H2O.
(3)减压过滤就是抽滤,抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是过滤速度快.
(4)若滤液②中c(Co2+)=3.0mol•L-1,加入等体积的(NH4)2C2O4后,钴的沉降率达到99.9%,计算滤液③中 c(C2O42-)=4.2×10-5mol•L-1.
(5)采用有机物萃取Li+的方法可提取锂.其中有机物中加入一定量Fe3+以提高萃取率,D为离子在有机层与水层的分配比.图2是其他条件不变,水相的酸度与D(H+)、D(Li+)的变化图象.解释萃取液酸度控制在0.05mol•L-1的原因可抑制萃取剂中Fe3+水解,同时此酸度时,Li+的萃取率较高.(写2点)
(6)在反应③中用草酸铵作沉淀剂,25℃时,(NH4)2C2O4溶液pH<7(填“=”或“>”或“<”).
| A. |  | B. |  | C. |  | D. |  |

| A. | 溶液pH≤2时,生铁发生吸氧腐蚀 | |
| B. | 在酸性溶液中生铁只能发生析氢腐蚀 | |
| C. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| D. | 两溶液中负极反应均为Fe-2e-=Fe2+ |

 CH2-CHCl
CH2-CHCl .
.