题目内容
4.某溶液中只可能含有下列离子中的某几种:K+、NH4+、Ba2+、SO42-、I-、AlO2-.分别取样:①用pH计测试,溶液显弱酸性②加氯水和CCl4振荡后静置,下层呈无色,为确定该溶液的组成,还需检验的离子是( )| A. | K+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
分析 ①用pH计测试,溶液显弱酸性,则一定不含AlO2-,且Ba2+、SO42-不能共存;
②加氯水和CCl4振荡后静置,下层呈无色,则一定不含I-,
由电荷守恒可知,一定存在阴离子为SO42-,则原溶液不存在Ba2+,
因溶液为弱酸性可知,含阳离子一定为NH4+,以此来解答.
解答 解:①用pH计测试,溶液显弱酸性,则一定不含AlO2-,且Ba2+、SO42-不能共存;
②加氯水和CCl4振荡后静置,下层呈无色,则一定不含I-,
由电荷守恒可知,一定存在阴离子为SO42-,则原溶液不存在Ba2+,
因溶液为弱酸性可知,含阳离子一定为NH4+,则还需检验的离子为K+,利用焰色反应,
故选A.
点评 本题考查常见离子的检验,为高频考点,把握离子反应、离子共存、盐类水解为本题的关键,侧重分析与应用能力的考查,注意电荷守恒的应用,题目难度不大.

练习册系列答案
 每课必练系列答案
每课必练系列答案
相关题目
13.化学与生活息息相关相关.下列说法正确的是( )
| A. | 工业污水可以直接用于灌溉农田 | |
| B. | 爆竹燃烧时,其中的硫磺燃烧生成三氧化硫 | |
| C. | 碳酸氢钠、氢氧化铝都可作为治疗胃酸过多的药物 | |
| D. | 食品袋中装有生石灰的透气小袋是用于防止食品氧化变质 |
14.下列离子方程式正确的是( )
| A. | 饱和石灰水跟稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 除去硫酸铁溶液中的亚铁离子:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 将数滴0.lmol/L盐酸溶液缓缓滴入lmol/L50mLNa2CO3溶液中,且不断搅拌:2H++CO32-═H2O+CO2↑ | |
| D. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
11.t℃(高于850℃),在相同容器中发生上述反应,容器内各物质变化如表.
①表中3min~4min之间反应达到平衡(达到平衡,正向进行,逆向进行);C1数值大于0.08mol•L-1(填大于、小于或等于).
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | c2 | c3 | c3 |
| 4 | C1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
②反应在4min~5min问,平衡向逆方向移动,可能的原因是d(单选),表中5min~6min之间数值发生变化,可能的原因是a(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
18.下列叙述正确是( )
| A. | 乙酸和乙醇酯化时,采用沸水浴加热 | |
| B. | 可用先加NaOH再分液方法,除去乙醇中的乙酸乙酯 | |
| C. | 可通过灼烧再闻气味的方法,区分蚕丝和羊毛 | |
| D. | 可通过分馏煤焦油,得到苯、二甲苯等有机原料 |
9.某化学兴趣小组利用如图所示装置对SO2的性质进行实验研究.
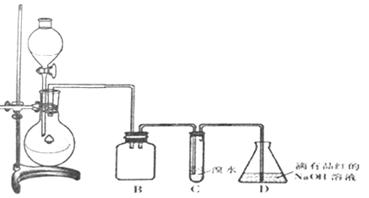
请回答下列问题:
(1)装置B的作用是防止倒吸.
(2)装置C的目的是检验SO2还原性.装置D中NaOH全部转化为NaHSO3的标志是溶液红色退去.
(3)向装置D所得NaHSO3溶液中加入漂白粉,有三种可能的情况:
I.HSO3-与ClO-刚好反应完 II.漂白粉不足 III.漂白粉过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定属于哪一种情况,请完成表.
(已知酸性:H2SO4>H2CO3>HClO)
(4)该小组同学认为,SO2通入含有BaCl2的双氧水中会出现白色沉淀,该反应的离子方程式为SO2+Ba2++H2O2=BaSO4+2H+.

请回答下列问题:
(1)装置B的作用是防止倒吸.
(2)装置C的目的是检验SO2还原性.装置D中NaOH全部转化为NaHSO3的标志是溶液红色退去.
(3)向装置D所得NaHSO3溶液中加入漂白粉,有三种可能的情况:
I.HSO3-与ClO-刚好反应完 II.漂白粉不足 III.漂白粉过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定属于哪一种情况,请完成表.
(已知酸性:H2SO4>H2CO3>HClO)
| 实验序号 | 实验操作 | 现象 | 可能的情况 |
| ① | 滴加少量淀粉-KI溶液,振荡 | III | |
| ② | 滴加少量溴水,振荡 | II | |
| ③ | 滴加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
16.某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)+2B(g)?4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6mol C,则下列说法正确的是( )
| A. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C)•{c}^{2}(D)}{{c}^{3}(A)•{c}^{2}(B)}$ | |
| B. | 此时,B的平衡转化率是40% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 增大B,平衡向右移动B的平衡转化率不变 |



