题目内容
7.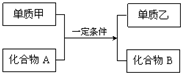 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:(1)若单质甲是生活中用途最广泛的金属,单质乙是最轻的气体,则甲是Fe.
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的离子反应方程式为2Na+2H2O=2Na++2OH-+H2↑.
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式.SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
(4)若气体单质乙能在空气中燃烧,化合物B为黑色磁性晶体,写出该反应的化学方程式3Fe3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
分析 (1)单质甲是生活中用途最广泛的金属,应为Fe,单质乙是最轻的气体,应为H2,则甲与化合物的反应为铁与酸发生置换反应,符合转化关系;
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,且为置换反应,则A为H2O,甲为Na,乙为H2,B为NaOH;
(3)工业上利用置换反应原理制备一种半导体材料,常见反应为SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)若化合物B为黑色磁性晶体,气体单质乙能在空气中燃烧,B为Fe3O4,乙为H2,甲和化合物A的反应为铁和水蒸气的反应.
解答 解:(1)单质甲是生活中用途最广泛的金属,应为Fe,单质乙是最轻的气体,应为H2,则甲与化合物的反应为铁与酸发生置换反应,反应的离子方程式为:Fe+2H+=Fe2++H2↑,
故答案为:Fe;
(2)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,且为置换反应,则A为H2O,甲为Na,乙为H2,B为NaOH,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
(3)工业上利用置换反应原理制备一种半导体材料,常见反应为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(4)若化合物B为黑色磁性晶体,气体单质乙能在空气中燃烧,B为Fe3O4,乙为H2,甲和化合物A的反应为铁和水蒸气的反应,反应的化学方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查无机推断,题目难度中等,明确常见元素及其化合物性质是解关键,注意掌握常见物质间的置换反应类型,如金属间的置换反应、非金属间的置换反应、金属和非金属之间的置换反应等,试题有利于培养学生的分析、理解能力及逻辑推理能力.

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案| A. | 常温常压下,28g氮气的体积约为22.4升 | |
| B. | 标准状况下,11.2L水含有1mol氢原子 | |
| C. | 标准状况下,11.2L氧气与硫充分反应,转移的电子数目为2NA | |
| D. | 常温常压下,1mol氯气完全被碱吸收需要NA个氢氧根离子 |
| 物质 | 试剂 | 分离方法 | |
| ① | 氯化钠(硝酸钾) | 蒸馏水 | 降温结晶 |
| ② | 二氧化碳(氯化氢) | 饱和碳酸钠溶液 | 洗气 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 分液 |
| A. | ②③ | B. | ①③ | C. | 只有③ | D. | ③④ |
| A. | Zn为电池的负极,被氧化 | B. | O2为负极,被还原 | ||
| C. | 该电池的总反应是2Zn+O2=2ZnO | D. | 该电池是将化学能转化为电能 |
| ① | ② | ③ | 实验结论 |  | |
| A. | 硫酸 | Na2SO3 | KMnO4 | SO2有漂白性 | |
| B. | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
| C. | H2O | 工业电石 | KMnO4 | 乙炔具有还原性 | |
| D. | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
| A. | c(SO2)=0.1mol/L | B. | c(O2)=0.05mol/L | C. | c(SO3)=0.5mol/L | D. | c(SO2)=0.4mol/L |
| A. | 元素X:它的原子中M层比L层少2个电子 | |
| B. | 元素Z:位于元素周期表中的第三周期第ⅢA 族 | |
| C. | 元素Y:它的二价阳离子核外电子总数与氩原子相同 | |
| D. | 元素W:它的焰色反应颜色呈紫色 |
| A. | HF | B. | NaCl | C. | HCl | D. | KOH |