题目内容
9.现有反应在密闭容器中进行:mA(g)+nB(g)?pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:(1)m+n> p(填“>”“=”“<”).
(2)减压时,A的质量分数增大.(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率增大.
(4)若升高温度,则平衡时B、C的浓度之比$\frac{c(B)}{c(C)}$将减小.(体积不变)
(5)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色变深 (填“变深”“变浅”或“不变”).
分析 (1)减小压强平衡向气体体积增大的方向移动;
(2)减小压强C的质量分数减小,平衡逆向移动;
(3)体积不变时加入B,平衡正向移动;
(4)升高温度B的转化率增大,平衡正向移动,B的物质的量浓度减小、C的物质的量浓度增大;
(5)体积不变时,加入C时,平衡逆向移动.
解答 解:(1)减小压强平衡向气体体积增大的方向移动,减小压强C的质量分数减小平衡逆向移动,则m+n>p,
故答案为:>;
(2)减小压强C的质量分数减小,平衡逆向移动,则A的转化率降低,A的质量分数增大,故答案为:增大;
(3)体积不变时加入B,平衡正向移动,则A的转化率增大,故答案为:增大;
(4)升高温度B的转化率增大,平衡正向移动,B的物质的量浓度减小、C的物质的量浓度增大,所以则平衡时B、C的浓度之比$\frac{c(B)}{c(C)}$将减小,故答案为:减小;
(5)体积不变时,加入C时,平衡逆向移动,B的浓度增大,颜色变深,故答案为:变深.
点评 本题考查外界条件对化学平衡移动影响,为高频考点,明确外界条件对化学平衡移动影响原理是解本题关键,侧重考查学生分析判断能力,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 酸性氧化物 干冰 CO2 | B. | 碱 纯碱 Na2CO3 | ||
| C. | 酸 硫酸 H2SO3 | D. | 单质 氯水 Cl2 |
20.(1)在一密闭容器中一定量A、B的混合气体发生反应:aA(g)+bB(g)?cC(s)+dD(g),
平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20mol/L.下列有关判断一定正确的是D
A.平衡向正反应方向移动
B.A的转化率增大
C.D的体积分数增大
D.a+b<c+d
(2)①25℃,两种酸的电离平衡常数如表.
HSO3-的电离平衡常数表达式K=$\frac{c({H}^{+})•c(S{{O}_{3}}^{2}{\;}^{-})}{c(HS{O}_{3}{\;}^{-})}$.
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20mol/L.下列有关判断一定正确的是D
A.平衡向正反应方向移动
B.A的转化率增大
C.D的体积分数增大
D.a+b<c+d
(2)①25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
③根据H2SO3的电离常数数据,判断NaHSO3溶液显酸性还是显碱性?
4.已知下列物质在20℃下的Ksp如下,试回答下列问题:
(1)20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是:Ag2CrO4>AgCl>AgBr>AgI>Ag2S.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.
(3)测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是D.
A.KBr B.KI C.K2S D.K2CrO4.
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=2.7×10-3.
(3)测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是D.
A.KBr B.KI C.K2S D.K2CrO4.
18.下列图示与对应的叙述相符的是( )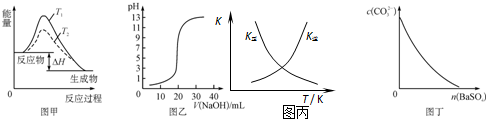

| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00 mL 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
19.某KNO3溶液中含杂质KCl和Ca(NO3)2,现欲除去杂质,得到纯净的KNO3溶液,则加入试剂的正确顺序是( )
| A. | AgNO3、K2CO3 | B. | AgNO3、K2CO3、HNO3 | ||
| C. | K2CO3、AgNO3 | D. | K2CO3、AgNO3、HNO3 |
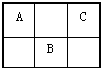 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.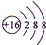 、
、 .
.