题目内容
2.用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作: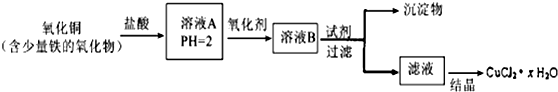
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解.
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+.能检验溶液A中Fe2+的试剂为①(填编号,下同) ①KMnO4 ②(NH4)2S ③NaOH ④KSCN
(2)氧化剂可选用①④.
①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用③④⑤.
①NaOH ②FeO ③CuO ④Cu(OH)2 ⑤Cu2(OH)2CO3
(4)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需250mL容量瓶,下列滴定方式中(夹持部分略去),最合理的是b(填序号)
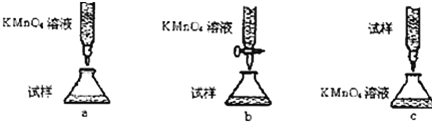
写出滴定反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
(5)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x的值,某兴趣小组设计了两种实验方案:(已知CuCl2的摩尔质量为135g/mol;H2O的摩尔质量为18g/mol)
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g.
方案二:称取m g晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得固体的质量为n2g.
试评价上述两种实验方案:其中正确的方案是二,
据此计算得x=$\frac{80m-135{n}_{2}}{18{n}_{2}}$(用含m、n1或n2的代数式表示).
(6)某同学想利用氯化钠设计一套实验装置来电解饱和食盐水,并检验氯气的氧化性和测定所产生的氢气的体积(约8mL).
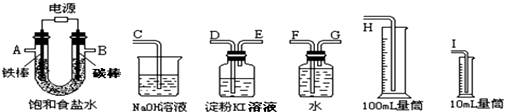
试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接G,F接I;B接D,E接C;
(7)若装入的饱和食盐水为75mL(氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL(标准状况)时停止通电.将U形管内的溶液倒入烧杯,其pH约为12.
分析 用含少量铁的氧化物的氧化铜加盐酸溶解生成氯化铜、氯化铁、氯化亚铁,加氧化剂把亚铁离子氧化为铁离子,再调节pH,铁离子转化为氢氧化铁沉淀,过滤得到的滤液为氯化铜溶液,蒸发浓缩、冷却结晶得到氯化铜晶体,
(1)亚铁离子具有还原性,能被高锰酸钾氧化为三价铁,使高锰酸钾褪色;
(2)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质;
(3)在制取过程中,不能引进杂质离子,据此来选择合适的试剂;
(4)根据配制一定物质的量浓度的KMnO4溶液所需仪器和高锰酸钾的性质来分析;
(5)CuCl2•xH2O晶体加热时会发生水解;加热沉淀至质量不再减轻为止,ng为CuO质量,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),再结合m=nM计算x的值;
(6)根据实验的目的和装置的作用来连接装置;
(7)根据电解饱和食盐水的方程式:计算NaOH的物质的量浓度,然后求出氢离子的浓度,最后求出pH.
解答 解:(1)亚铁离子具有还原性,能被高锰酸钾氧化为三价铁,使高锰酸钾褪色,是检验溶液A中Fe2+的最佳试剂,
故答案为:①;
(2)根据题意,加入氧化剂可把Fe2+氧化为Fe3+,而没有增加新杂质,所以氧化剂为H2O2或是Cl2,KMnO4和HNO3 会引入杂质离子;
故答案为:①④;
(3)得到较纯的产品,需要调节pH使铁离子转化为沉淀,选择的试剂可以是CuO、Cu(OH)2或Cu2(OH)2CO3,而①②均会引入杂质离子;
故答案为:③④⑤;
(4)配制一定物质的量浓度的KMnO4溶液需要的仪器有:天平、玻璃棒、烧杯、胶头滴管、250mL容量瓶,高锰酸钾具有强氧化性,必须放在酸式滴定管中,滴定过程高锰酸根离子将亚铁离子氧化为铁离子,发生的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:250mL容量瓶;b;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(5)CuCl2•xH2O晶体加热时会发生水解CuCl2+2H2O?Cu(OH)2+2HCl,有HCl气体放出,CuCl2质量偏小,测得x值偏大,
所以选择方案二,氯化铜和氢氧化钠反应生成氢氧化铜沉淀,加热沉淀,氢氧化铜分解生成氧化铜,则ng为CuO质量,物质的量为:$\frac{{n}_{2}}{80}mol$,根据铜元素守恒可知,n(CuO)=n(CuCl2•xH2O),所以mg=$\frac{{n}_{2}}{80}$mol×(135+18x)g/mol,解得,x=$\frac{80m-135{n}_{2}}{18{n}_{2}}$;
故答案为:二;$\frac{80m-135{n}_{2}}{18{n}_{2}}$;
(6)产生的氢气的体积用排水量气法,氢气的体积(约8mL),所以需要用10mL的量筒,导管是短进长出,所以A接G,F接I,用装有淀粉碘化钾溶液的洗气瓶检验氯气时,导管要长进短出,所以B接D,氯气要进行尾气处理,即E接C;
故答案为:G、F、I;D、E、C;
(7)因电解饱和食盐水的方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,当产生的H2的体积为8.4mL即0.000375mol时,生成氢氧化钠的物质的量为0.00075mol,所以溶液中NaOH的物质的量浓度=$\frac{0.00075}{0.075}$═0.01mol/L,所以氢离子的浓度为$\frac{1×1{0}^{-14}}{0.01}$=1×10-12mol/L,pH=12,
故答案为:12.
点评 本题考查氯化铜晶体的制取实验流程,涉及氧化还原反应、亚铁离子的检验、物质含量的测得、除杂质、电解池原理等,题目难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,注意基础知识的全面掌握.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案| A. | 标准状况下,44.8 LH2O含有的水分子数为2NA | |
| B. | 88gC02含有的C02分子数为2NA | |
| C. | 46gNO2气体含有的氧原子数为NA | |
| D. | 1mol的任何气体中都含有NA个原子 |
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
| A. | 480mL 56.2g | B. | 500mL 58.5g | ||
| C. | 1000mL 58.5g | D. | 任意规格 56.2g |
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:①试管;②胶头滴管(请填写一件主要的玻璃仪器).
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容:(在下列空格内填写相关内容)
| 序号 | 实验方案 | 实验现象 | 化学方程式 |
| ① | 将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为橙红色 | Cl2+2NaBr=2NaCl+Br2 |
| ② | 将少量溴水加入盛有碘化钾溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入溴水后,溶液由无色变为褐色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为紫红色 |
(5)请用原子结构理论简单说明上述结论的原因:同一主族,自上而下,元素原子的核外电子层数增多,原子半径增大,核对外层电子的引力逐渐减弱,得电子能力逐渐减弱.
| ① | ② | |
| A | 无明显现象 | 只有AgBr沉淀生成 |
| B | 生成淡黄色沉淀 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| C | 无明显现象 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| D | 生成黄色沉淀 | AgCl和AgBr沉淀都有,但AgBr沉淀更多 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 将0.1mol氨充分溶解在1L水中 | |
| B. | 将10g质量分数为98%的硫酸与990g水混合 | |
| C. | 将10mL•1mol•L-1的盐酸与90mL水充分混合 | |
| D. | 将25.0g胆矾(CuSO4•5H2O)溶于水配成1L溶液 |
| A. | 碘酒可使蛋白质变性,故能消毒杀菌 | |
| B. | 天然氨基酸能溶于强酸或强碱溶液,在两性化合物 | |
| C. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸中的大 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |
 如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答:
如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答: