题目内容
8.关于硅的下列叙述中,正确的是?( )| A. | 晶体硅与金刚石分子都是正四面体结构 | |
| B. | 硅酸盐都不溶于水? | |
| C. | 硅与酸、碱都不能发生反应 | |
| D. | 原硅酸和硅酸对应的酸酐都是二氧化硅 |
分析 A、晶体硅与金刚石不是分子,而是原子;
B、硅酸钠溶于水;
C、硅与氢氟酸、氢氧化钠发生反应;
D、二氧化硅是原硅酸和硅酸对应的酸酐.
解答 解:A、晶体硅与金刚石不是分子,而是原子,都是空间网状结构,故A错误;
B、硅酸钠溶于水,故B错误;
C、硅与氢氟酸生成四氟化硅、硅与氢氧化钠发生反应生成氢气,故C错误;
D、二氧化硅是原硅酸和硅酸对应的酸酐,所以原硅酸和硅酸对应的酸酐都是二氧化硅,故D正确;
故选D.
点评 本题考了元素化合物知识,熟悉硅及其氧化物性质是解题关键,注意二氧化硅特性,能够与氢氟酸在常温下反应,题目难度不大.

练习册系列答案
相关题目
19.下列四组反应中既有沉淀产生又有气体放出的是( )
| A. | 金属钠投入到Na2SO4溶液中 | B. | BaCl2和NaHSO4溶液反应 | ||
| C. | 小苏打溶液和澄清石灰水反应 | D. | Na2O2和CuSO4溶液反应 |
16.H2O2是一种常用绿色氧化剂,在化学研究中应用广泛.
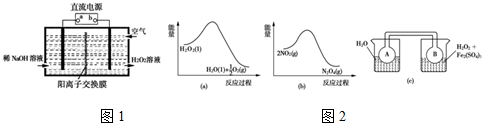
(1)空气阴极法电解制备H2O2的装置如图1所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物.试回答:
①直流电源的a极名称是正极.
②阴极电极反应式为O2+2e-+2H2O=H2O2+2OH-.
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2.相对于电解法,该方法具有的优点是安全、能耗低.
(2)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动.
(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜.反应的离子方程式是Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O,控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.

(1)空气阴极法电解制备H2O2的装置如图1所示,主要原理是在碱性电解质溶液中,通过利用空气中氧气在阴极还原得到H2O2和稀碱的混合物.试回答:
①直流电源的a极名称是正极.
②阴极电极反应式为O2+2e-+2H2O=H2O2+2OH-.
③1979年,科学家们用CO、O2和水在三苯膦钯的催化下室温制得了H2O2.相对于电解法,该方法具有的优点是安全、能耗低.
(2)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深(填“深”或“浅”),其原因是H2O2分解放热,使平衡2NO2═N2O4向生成NO2方向移动.
(3)用H2O2 和H2SO4 的混合溶液可溶解印刷电路板金属粉末中的铜.反应的离子方程式是Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O,控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol•L-1H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
20.在容积不变的密闭容器中进行如下反应:N2+3H2?2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,下列说法错误的是( )
| A. | NH3的质量分数将增加 | B. | 平衡向正反应方向移动 | ||
| C. | 平衡向逆反应方向移动 | D. | 正逆反应速率都增大 |
17.将少量金属钠投入下列稀溶液中,溶液质量减少的是( )
| A. | NaCl | B. | NaOH | C. | NH4NO3 | D. | Ca(HCO3)2 |
18.下列物质的一氯取代物的同分异构体数目相同的是( )


| A. | ①② | B. | ③④ | C. | ②③ | D. | ②④ |
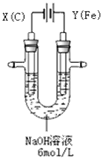 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.