题目内容
Ⅰ.在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:Cr2O72-+H2O?2CrO42-+2H+,把重铬酸钾(K2Cr2O7)溶于水配成稀溶液是橙色.
(1)向上述溶液中加入NaOH溶液,溶液呈 色,因为 .
(2)上述反应平衡常数表达式K=
Ⅱ.将CoCl2溶解于盐酸中可以形成CoCl42-,在溶液中存在下面的化学平衡:Co(H2O)62+[粉红色]+4Cl-?6H2O+CoCl42-[蓝色]△H>0.取一支试管,向其中加入少量氯化钴晶体,再逐滴加入浓盐酸至晶体完全溶解,然后滴加水至溶液呈紫色为止.将所得溶液分装于二支试管中,
(1)其一将所得溶液置于热水中,观察到的实验现象是 ,因为 .
(2)其二将所得溶液加水稀释[稀释过程的变化相当于化学平衡移动原理中改变压强的变化],稀释一倍后,重新达到平衡时,
(填“增大”、“减小”或“不变”).
(3)该反应的升高温度,K值将 (填“增大”、“减小”或“不变”).
(1)向上述溶液中加入NaOH溶液,溶液呈
(2)上述反应平衡常数表达式K=
Ⅱ.将CoCl2溶解于盐酸中可以形成CoCl42-,在溶液中存在下面的化学平衡:Co(H2O)62+[粉红色]+4Cl-?6H2O+CoCl42-[蓝色]△H>0.取一支试管,向其中加入少量氯化钴晶体,再逐滴加入浓盐酸至晶体完全溶解,然后滴加水至溶液呈紫色为止.将所得溶液分装于二支试管中,
(1)其一将所得溶液置于热水中,观察到的实验现象是
(2)其二将所得溶液加水稀释[稀释过程的变化相当于化学平衡移动原理中改变压强的变化],稀释一倍后,重新达到平衡时,
c(Co(H2O
| ||
c(CoC
|
(3)该反应的升高温度,K值将
考点:化学平衡的影响因素
专题:化学平衡专题
分析:Ⅰ.(1)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,水不需要写出,据此书写;
Ⅱ.(1)正反应是吸热反应,则上述平衡正向移动;
(2)加水稀释促进水解,平衡逆向移动;
(3)正反应是吸热反应,温度升高K值变大.
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,水不需要写出,据此书写;
Ⅱ.(1)正反应是吸热反应,则上述平衡正向移动;
(2)加水稀释促进水解,平衡逆向移动;
(3)正反应是吸热反应,温度升高K值变大.
解答:
解:Ⅰ.(1)加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动,溶液呈黄色,故答案为:黄;加入少量NaOH固体,中和氢离子,氢离子浓度降低,平衡向右移动;
(2)根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)的平衡常数K=
,故答案为:
;
Ⅱ.(1)正反应是吸热反应,则上述平衡正向移动,溶液由粉红色逐渐变蓝色,故答案为:粉红色逐渐变蓝色;正反应是吸热反应,则上述平衡正向移动;
(2)加水稀释促进水解,平衡逆向移动,所以
增大,故答案为:增大;
(3)正反应是吸热反应,温度升高K值变大,故答案为:增大.
(2)根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)的平衡常数K=
c2(Cr
| ||
c(Cr2
|
c2(Cr
| ||
c(Cr2
|
Ⅱ.(1)正反应是吸热反应,则上述平衡正向移动,溶液由粉红色逐渐变蓝色,故答案为:粉红色逐渐变蓝色;正反应是吸热反应,则上述平衡正向移动;
(2)加水稀释促进水解,平衡逆向移动,所以
c(Co(H2O
| ||
c(CoC
|
(3)正反应是吸热反应,温度升高K值变大,故答案为:增大.
点评:本题考查化学平衡常数及平衡移动,明确温度、稀释及浓度对化学平衡的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
化学与能源开发、环境保护、食品安全、资源利用等密切相关.下列说法正确的是( )
| A、化石燃料的液化与气化技术非常成熟且大量应用时,就无需开发新能源 |
| B、绿色化学的核心是应用化学原理对环境污染进行治理 |
| C、在食用盐中添加适量的碘酸钾(KIO3)不符合食品的安全要求 |
| D、垃圾是放错地方的资源,应当分类处理和回收利用 |
下列变化不属于水解反应的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、HS-+H2O?H3O++S2- |
| C、HS-+H2O?H2S+OHˉ |
| D、NH4++2H2O?NH3?H2O+H3O+ |
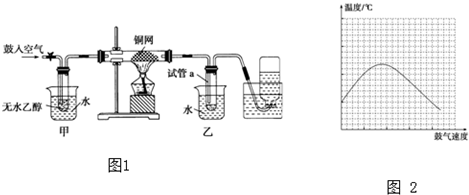
 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
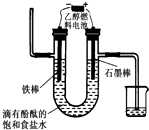 据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实.
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实. 如图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出).
如图所示为某化学兴趣小组设计的乙醇催化氧化及其产物检验的实验装置(图中加热仪器、铁架台、铁夹等均未画出).