题目内容
(1)R、M两种元素所在周期的元素种类分别为n和m.若R的原子序数为x,当R、M均为 IA族元素,且M在R的下一周期时,M的原子序数为 ;当R、M均为 VIIA族元素且M在R的下一周期时,M的原子序数为 .(用x、m、n的代数式表示)
(2)在ds区中,族序数最大.原子序数最小的元素,其原子的价电子排布式为 ;第四周期中,未成对电子数最多的原子是 填元素符号),其未成对电子数是 个.
(3)CH3+、-CH3都是很重要的有机反应中间体,它们的电子式分别是 、 ;其中CH3+的键角应是 .
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为: .
(2)在ds区中,族序数最大.原子序数最小的元素,其原子的价电子排布式为
(3)CH3+、-CH3都是很重要的有机反应中间体,它们的电子式分别是
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-.不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为:
考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:(1)R、M两种元素所在周期的元素种类分别为n和m.若R的原子序数为x,当R、M均为 IA族元素,且M在R的下一周期时,当R、M均为 IA族元素,且M在R的下一周期时,M的原子序数为R所在周期的元素种类数;R、M均为 VIIA族元素且M在R的下一周期时,M的原子序数为,与R、M同在ⅠA族相反;
(2)在ds区中,族序数最大.原子序数最小的元素是30号锌,其原子的价电子排布式为3d104s2,第四周期中,未成对电子数最多的原子是Cr有6对未成对电子;
(3)根据正离子,是缺电子及原子的最外层电子数来分析电子式;
(4)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键.
(2)在ds区中,族序数最大.原子序数最小的元素是30号锌,其原子的价电子排布式为3d104s2,第四周期中,未成对电子数最多的原子是Cr有6对未成对电子;
(3)根据正离子,是缺电子及原子的最外层电子数来分析电子式;
(4)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键.
解答:
解:(1)R、M两种元素所在周期的元素种类分别为n和m.若R的原子序数为x,当R、M均为 IA族元素,且M在R的下一周期时,当R、M均为 IA族元素,且M在R的下一周期时,M的原子序数为R所在周期的元素种类数;R、M均为 VIIA族元素且M在R的下一周期时,M的原子序数为,与R、M同在ⅠA族相反,故答案为:x+n; x+m;
(2)在ds区中,族序数最大.原子序数最小的元素是30号锌,其原子的价电子排布式为3d104s2,第四周期中,未成对电子数最多的原子是Cr有6对未成对电子,
故答案为:3d104s2,Cr,6;
(3)因碳原子最外层4个电子,则CH3+是缺电子的碳正离子,可看作是甲基失去一个电子后的产物.甲基的电子式为 ,则CH3+的电子式为
,则CH3+的电子式为 ,其中CH3+中碳是sp2杂化,所以键角为 120°,故答案为:
,其中CH3+中碳是sp2杂化,所以键角为 120°,故答案为: 、
、 、120°;
、120°;
(4)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为 ,
,
故答案为: .
.
(2)在ds区中,族序数最大.原子序数最小的元素是30号锌,其原子的价电子排布式为3d104s2,第四周期中,未成对电子数最多的原子是Cr有6对未成对电子,
故答案为:3d104s2,Cr,6;
(3)因碳原子最外层4个电子,则CH3+是缺电子的碳正离子,可看作是甲基失去一个电子后的产物.甲基的电子式为
 ,则CH3+的电子式为
,则CH3+的电子式为 ,其中CH3+中碳是sp2杂化,所以键角为 120°,故答案为:
,其中CH3+中碳是sp2杂化,所以键角为 120°,故答案为: 、
、 、120°;
、120°;(4)[Cu(OH)4]2-中与Cu2+与4个OH-形成配位键,可表示为
 ,
,故答案为:
 .
.
点评:本题综合考查物质的结构与性质知识,侧重于电子排布式、杂化类型与配位键等知识,题目难度中等,注意把握杂化类型的判断方法.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
下列有关活化分子和活化能的说法不正确的是( )
| A、增加气体反应物的浓度可以提高活化分子百分数 |
| B、升高温度可增加单位体积活化分子数 |
| C、发生有效碰撞的分子一定是活化分子 |
| D、使用催化剂可降低活化能,提高单位体积活化分子百分数 |
标准状况下有①0.112L水 ②3.01×1023个氯化氢分子 ③13.6g H2S气体 ④0.2mol氨气,下列对这四种物质的关系由小到大排列正确的是( )
| A、体积:①④③② |
| B、密度:④①②③ |
| C、质量:①④③② |
| D、氢原子数:①③④② |
 某化合物的结构示意图如右,下列关于该化合物的叙述中正确的是( )
某化合物的结构示意图如右,下列关于该化合物的叙述中正确的是( )| A、该化合物只含有H、N、O、Ni四种元素 |
| B、该化合物是配合物,中心离子的配位数是2,配体是氮元素 |
| C、该化合物属于配合物,中心离子是Ni离子 |
| D、该化合物不属于配合物,而是属于高分子化合物 |

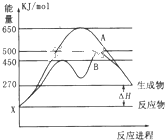 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示. 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答: