题目内容
10.聚合氯化铝是新型、高效絮凝剂和净水剂,其单体是液态碱式氯化铝([Al2(OH)nCl6-n]),工业上常采用铝盐溶液部分水解制备碱式氯化铝,其工艺流程如下: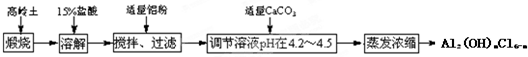
已知:高岭土:Al2O3(25%~34%),SiO2(40%~50%)、Fe2O3(0.5%~3.0%)及少量杂质和水,Al3+以氢氧化物形式完全沉淀时,溶液的pH为5.2,根据流程图回答下列问题:
(1)写出溶解过程中反应的离子方程式Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O
(2)加适量铝粉的主要目的是除去溶液中的铁元素
(3)溶液的pH需控制在4.2~4.5的原因是利用水解反应得到液体聚合氯化铝,防止生成氢氧化铝沉淀.
分析 加入盐酸,二氧化硅不反应,Al2O3、Fe2O3与盐酸反应生成氯化铝、氯化铁,加入适量铝粉,过滤,除去溶液中的铁离子,在滤液中加入适量碳酸钙调节pH在4.2~4.5,将溶液蒸发浓缩,可得到[Al2(OH)nCl6-n],以此解答该题.
解答 解:加入盐酸,二氧化硅不反应,Al2O3、Fe2O3与盐酸反应生成氯化铝、氯化铁,加入适量铝粉,过滤,除去溶液中的铁离子,在滤液中加入适量碳酸钙调节pH在4.2~4.5,将溶液蒸发浓缩,可得到[Al2(OH)nCl6-n],
(1)“溶解”过程反应的离子方程式有 Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,故答案为:Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O;
(2)加入铝粉最主要作用是:除去溶液中的铁元素,故答案为:除去溶液中的铁元素;
(3)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝,防止生成氢氧化铝沉淀,故答案为:利用水解反应得到液体聚合氯化铝,防止生成氢氧化铝沉淀.
点评 本题考查了物质制备方法和实验探究,为高频考点,掌握实验基本操作和理解实验原理是解题关键,题目难度中等,需要学生具备扎实的基础,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6. 图中
图中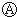 为直流电,
为直流电, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀池.接通电路后发现
为电镀池.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )
 图中
图中 为直流电,
为直流电, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀池.接通电路后发现
为电镀池.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A. | b为直流电的正极 | B. | e电极为铁 | ||
| C. | f极发生还原反应 | D. | d极发生的反应为:2H++2e-=H2↑ |
1.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在1 mol CaC2、KHSO4的混合物中含阴、阳离子的总数为3NA | |
| B. | 0.1 mol C2H5OH中所含C-H键的数目为0.6NA | |
| C. | S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA | |
| D. | 78gNa2O2与足量水反应转移的电子数为2NA |
17.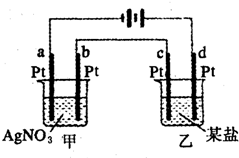 如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.64g某金属,下列说法正确的是( )
如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.64g某金属,下列说法正确的是( )
 如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.64g某金属,下列说法正确的是( )
如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.64g某金属,下列说法正确的是( )| A. | 甲池是b极上析出金属银,乙池是c极上析出某金属 | |
| B. | 甲池是a极上析出金属银,乙池是d极上析出某金属 | |
| C. | 某盐溶液可能是CuSO4溶液 | |
| D. | 某盐溶液可能是Mg(NO3)2溶液 |
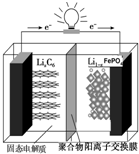 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4