题目内容
8.氧化还原反应和离子反应是高一所学过的重要化学反应类型,仔细思考回答下列问题(Ⅰ)下列一组有水参与的反应
①2Na+2H2O=2NaOH+H2↑ ②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH ④3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2
⑤2H2O$\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ ⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是③(填编号).
(2)在这些氧化还原反应中,水只作氧化剂的反应是①④(填编号)
水既作氧化剂,又作还原剂是⑤(填编号)
水只作还原剂的反应是⑥(填编号)
水既不作氧化剂,又不作还原剂是②(填编号).
(3)根据你的理解,氧化还原反应的实质是C.
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?是(填“是”或“不是”),若是,这个反应的还原剂和氧化剂的质量比是2:1.
分析 (1)存在化合价变化的反应是氧化还原反应;
(2)化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂;
(3)氧化还原反应的实质是电子的转移;
(4)化合价变化的反应是氧化还原反应;化合价升高元素所在的反应物是还原剂,化合价降低元素所在的反应物是氧化剂,据此计算.
解答 解:(1)存在化合价变化的反应是氧化还原反应,其中不属于氧化还原反应的是③;故答案为:③;
(2)在这些氧化还原反应中,化合价降低元素所在的反应物是氧化剂,水只作氧化剂的反应是①④;
⑤中水既作氧化剂,又作还原剂,H元素的化合价降低,O元素的化合价升高,
化合价升高元素所在的反应物是还原剂,水只作还原剂的反应是⑥;
②的水中元素化合价均不变,既不作氧化剂,又不作还原剂,故答案为:①④;⑤;⑥;②;
(3)根据你的理解,氧化还原反应的实质是电子的得失或共用电子对的偏移.
故选C;
(4)3NO2+H2O=2HNO3+NO属于氧化还原反应,二氧化氮既是氧化剂又是还原剂,还原剂和氧化剂的质量比是2:1,物质的量之比是2:1,故答案为:2:1.
点评 本题考查学生氧化还原反应中的基本概念知识,注意知识的迁移应用是关键,难度中等.

练习册系列答案
相关题目
3.下列化学用语中,用来表示石油裂解产物丙烯的是( )
| A. | 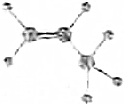 | B. | C3H6 | ||
| C. | 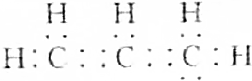 | D. | CH2═CHCH3 |
16.下列各组离子能够大量共存的是( )
| A. | pH=1的溶液中:Al3+、Mg2+、Cl-、SO42- | |
| B. | 使pH试纸显蓝色的溶液中:Cu2+、Fe2+、NO3-、SO42- | |
| C. | 滴入甲基橙指示剂呈红色的溶液中:K+、NH4+、CO32-、NO3- | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的溶液中:K+、NH4+、HCO3-、Cl- |
3.下列有关说法正确的是( )
| A. | 氯水、液氯都含有氯气分子,均为混合物 | |
| B. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| C. | 胶体与溶液的分散质粒子均可以通过滤纸 | |
| D. | 氢氟酸可用于刻蚀玻璃,是利用SiO2酸性氧化物的性质 |
13.下列离子方程式表达正确的是( )
| A. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O=AgOH↓+NH4+ | |
| B. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O | |
| C. | H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 尼泊金酸(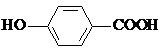 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: |
20.氢氧燃料电池,电极为多孔镍,电解质溶液为30%的KOH溶液,电池总反应为2H2+O2═2H2O,该电池工作时,下列说法正确的是( )
①负极质量减轻
②负极反应为O2+2H2O+4e-═4OH-
③负极反应为2H2+4OH--4e-═4H2O
④正极区pH升高,而负极区pH降低
⑤溶液中阴离子移向负极.
①负极质量减轻
②负极反应为O2+2H2O+4e-═4OH-
③负极反应为2H2+4OH--4e-═4H2O
④正极区pH升高,而负极区pH降低
⑤溶液中阴离子移向负极.
| A. | ①③④ | B. | ②③⑤ | C. | ③④⑤ | D. | ④⑤ |
17.如图是某燃煤发电厂处理废气的装置示意图.下列说法正确的是( )
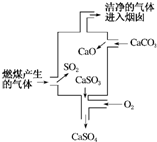

| A. | 使用此装置处理过的废气就不会对大气造成污染了 | |
| B. | 装置内发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用澄清的石灰水检验经过处理的废气是否达标 |
18. 我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可
我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可
以作为轻质金属材料的是( )
 我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可
我国高速列车制造技术具有世界领先水平.高速列车制造要使用轻质金属材料.下列可以作为轻质金属材料的是( )
| A. | 铝合金 | B. | 铜合金 | C. | 碳纤维 | D. | 硅纤维 |
