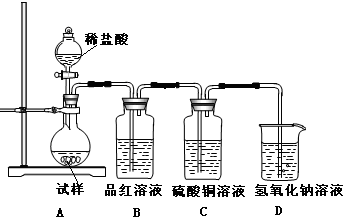
题目内容
17.如图是某燃煤发电厂处理废气的装置示意图.下列说法正确的是( )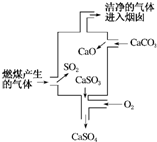
| A. | 使用此装置处理过的废气就不会对大气造成污染了 | |
| B. | 装置内发生的反应有化合、分解、置换和氧化还原反应 | |
| C. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| D. | 可用澄清的石灰水检验经过处理的废气是否达标 |
分析 根据图示进行分析,燃煤中含有硫,燃烧后生成二氧化硫,生成的二氧化硫可以使用碳酸钙处理,从而减少二氧化硫的排放,根据流程发生的反应进行回答.
解答 解:A、使用此装置处理过的废气仍然会对大气造成污染,知识减轻环境污染,故A错误;
B、碳酸钙分解能生成氧化钙和二氧化碳,属于分解反应,亚硫酸钙和氧气反应生成硫酸钙的反应是化合反应,属于氧化还原反应,没有置换反应,故B错误;
C、整个过程中,二氧化硫与碳酸钙和氧气反应生成了硫酸钙和二氧化碳,2SO2+2CaCO3+O2═2CaSO4+2CO2,故C正确;
D、整个过程中的二氧化硫和二氧化碳都可以是石灰水变浑浊,但是二氧化碳是无毒气体,故D错误;
故选C.
点评 本题考查了化学与环境保护的知识,注意物质的性质应用以及知识的归纳和梳理,要理解环境污染日趋严重,要保护环境,要树立保护环境人人有责的理念.

练习册系列答案
相关题目
5.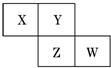 X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示.若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )| A. | X的最常见气态氢化物的水溶液显酸性 | |
| B. | 最高价氧化物对应水化物的酸性W比Z强 | |
| C. | Z的单质与氢气反应比Y单质与氢气反应剧烈 | |
| D. | X的原子半径小于Y |
12.我国古代发明或技术应用中,其工作原理不涉及化学反应的是
①指南针②黑火药③转轮排字④黏土制陶瓷⑤用玻璃瓶盛装“强水”(古书中记载一种能腐蚀五金的液体⑥用明矾溶液清洗铜镜表面的铜锈⑦湿法炼铜( )
①指南针②黑火药③转轮排字④黏土制陶瓷⑤用玻璃瓶盛装“强水”(古书中记载一种能腐蚀五金的液体⑥用明矾溶液清洗铜镜表面的铜锈⑦湿法炼铜( )
| A. | ①③④⑤ | B. | ①③⑤ | C. | ①③④⑦ | D. | ①③⑤⑥ |
2.下列说法或推理正确的是( )
| A. | 将Fe(N03)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(N03)2晶体已氧化变质 | |
| B. | 常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9 | |
| C. | 25℃时,Ksp( BaC03)>Ksp( BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好 | |
| D. | 将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解 |
7.下列各组离子在指定的溶液中,-定能大量共存的是( )
| A. | 在含有大量AlO2-的溶液中:Fe3+、Na+、NO3-、Cl- | |
| B. | 使淀粉碘化钾试纸变蓝的溶液中:K+、S2-、Cl-、HCO3- | |
| C. | 滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 与金属铝反应只能放出氢气的溶液中:NH4+、Cl-、Na+、NO3- |