题目内容
9.下列说法中错误的是( )| A. | CO2、SO3都是极性分子 | |
| B. | KF是离子化合物,HF为共价化合物 | |
| C. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| D. | PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
分析 A.对于ABn型分子,若中心原子A的最外层电子全部成键为非极性分子;
B.共价化合物是原子间以共用电子对所组成的化合物分子,通常是由非金属元素组成的;离子化合物是由阴、阳离子构成的,通常是由活泼金属元素和非金属元素组成;
C.根据形成配位键的条件,一方提供孤电子对,一方提供空轨道;
D.对于共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,据此判断.
解答 解:A.CO2、SO3的中心原子最外层电子全部成键,都是非极性分子,故A错误;
B.KF是由钾离子和氟离子构成的离子化合物,HF为非金属原子通过共价键形成的共价化合物,故B正确;
C.NH4+中氢离子含有空轨道,氮原子含有孤电子对,所以能形成配位键,[Cu(NH3)4]2+中铜离子含有空轨道,氮原子含有孤电子对,所以铜离子和氨分子能形成配位键,故C正确;
D.PCl3中P元素化合价为+3价,P原子最外层电子数是5,3+5=8,则P原子满足8电子结构,Cl元素化合价绝对值为1,其最外层电子数是7,1+7=8,则Cl原子满足8电子结构;NF3中N元素化合价为+3价,N原子最外层电子数是5,3+5=8,则N原子满足8电子结构,F元素化合价绝对值为1,其最外层电子数是7,1+7=8,则F原子满足8电子结构,故D正确;
故选A.
点评 本题主要考查分子的极性、化合物的类型、配位键形成的条件以及8电子结构的判断,难度中等,易错为C,解题时要形成配位键对离子或原子要求的特点来分析解答.

练习册系列答案
相关题目
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| B. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数目为0.5NA | |
| C. | 常温常压下,22.4L H2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
1.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯、苯与硝酸作用得到一硝基取代物的反应条件分别为30℃、50-60℃ |
18.下列实验操作中正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
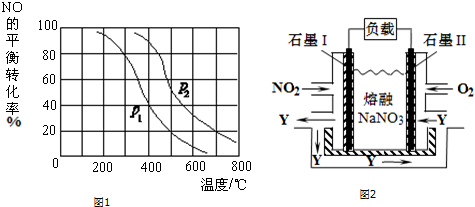
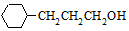 流程图如图
流程图如图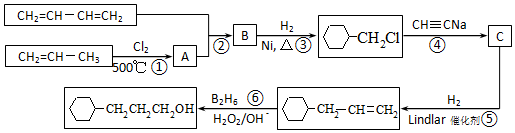
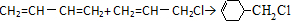 .
.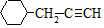 .
.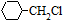 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式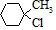 .
.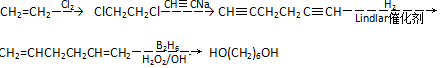 .
.