题目内容
6.常温下,将1mL pH=1的H2SO4溶液加水稀释到100 mL,稀释后的溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=108.分析 1mL pH=1的H2SO4溶液加水稀释到100mL,c(H+)由0.1mol/L变为0.001mol/L,结合Kw计算c(OH-),进而计算二者比值.
解答 解:1mL pH=1的H2SO4溶液加水稀释到100mL,c(H+)由0.1mol/L变为0.001mol/L,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$mol/L=10-11mol/L,则$\frac{c({H}^{+})}{c(O{H}^{-})}$=108,
故答案为:108.
点评 本题考查pH的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,明确浓度与pH的换算是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
16.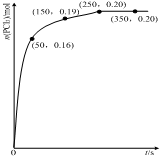 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g) PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的n(PCl3)随时间的变化如图,下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl5)=0.0032 mol•L-1•s-1 | |
| B. | 该反应的平衡常数K=0.025 | |
| C. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20molPCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时:c(PCl3)=0.11mol•L-1,则反应的△H<0 |
14.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| B. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数目为0.5NA | |
| C. | 常温常压下,22.4L H2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
1.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| C. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| D. | 甲苯、苯与硝酸作用得到一硝基取代物的反应条件分别为30℃、50-60℃ |
11.下列有关实验的说法错误的是( )
| A. | 向品红溶液中通入气体X,品红溶液褪色,则气体X可能是Cl2 | |
| B. | CO2中含少量SO2,可将该混合气体通人足量饱和NaHCO3溶液中除去SO2: | |
| C. | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色,说明该食盐试样中不含KIO3 | |
| D. | 相同体积、pH均为3的HA和HB两种酸的溶液分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 |
18.下列实验操作中正确的是( )
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体及上层液体均从下口放出 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
15.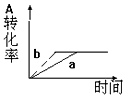 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)△H<0,图中曲线a 代表一定条件下该反应的过程,若使a曲线变为b曲线,可采用的措施是( )| A. | 增大A的浓度或减少C的浓度 | B. | 缩小容器的容积或加入催化剂 | ||
| C. | 升高温度或增大压强 | D. | 升高温度 |
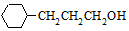 流程图如图
流程图如图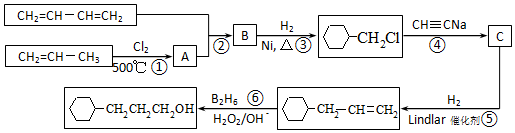
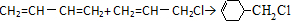 .
.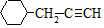 .
.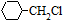 含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式
含有六元环且核磁共振氢谱有4组峰的同分异构体的结构简式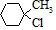 .
.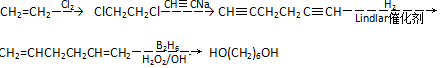 .
.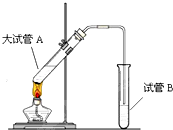 在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.请回答下列问题: