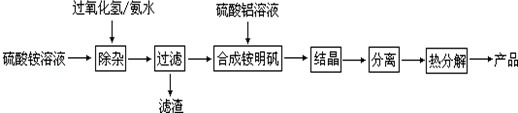
题目内容
15.如果a g某气体中含有的分子数为b,则c g该气体在标况下的体积是( )| A. | $\frac{22.4ab}{a{N}_{A}}$ | B. | $\frac{22.4ac}{b{N}_{A}}$ | C. | $\frac{22.4bc}{a{N}_{A}}$ | D. | $\frac{22.4b}{ac{N}_{A}}$ |
分析 计算cg气体含有分子数目,再根据n=$\frac{N}{{N}_{A}}$计算cg气体物质的量,根据V=nVm计算标准状况下cg气体的体积.
解答 解:a g某气体中含有该气体的分子数为b,则cg该气体含有分子数目为:$\frac{cg}{ag}$×b=$\frac{bc}{a}$,
则cg该气体的物质的量为:$\frac{\frac{bc}{a}}{{N}_{A}mo{l}^{-1}}$=$\frac{bc}{a{N}_{A}}$mol,
所以标况下cg该气体的体积为:$\frac{bc}{a{N}_{A}}$mol×22.4L/mol=$\frac{22.4bc}{a{N}_{A}}$L,
故选C.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、阿伏伽德罗常数之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.

练习册系列答案
相关题目
5.一定条件下,反应C(s)+H2O(g)?CO(g)+H2(g)△H>0达到平衡,下列有关叙述正确的是( )
| A. | 升高温度,v(正)增大,v(逆)减小 | |
| B. | 增加C的量,反应速率增大,转化率增大 | |
| C. | 恒温恒压,再充入N2,平衡不发生移动 | |
| D. | 恒温恒容,再充入CO,最终逆反应速率增大,正反应速率也增大 |
6.如图实验现象及所对应的离子方程式都正确的是( ) 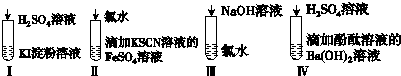

| 选项 | 现象 | 离子方程式 |
| A | I在空气中放置一段时间后,溶液呈蓝色 | 4I-+O2+2H2O═2I2+4OH- |
| B | II溶液由浅绿色变为红色 | Fe2++Cl2═Fe3++2Cl- Fe3++3SCN-═Fe(SCN)3 |
| C | III溶液 颜色无变化 | Cl2+2OH-═Cl-+ClO-+H2O |
| D | IV有白色沉淀生成,溶液由红色变无色 | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | A | B. | B | C. | C | D. | D |
10.已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生.若再加入双氧水,将发生反应:H2O2+2H++2I-→2H2O+I2,且生成的I2立即与试剂X反应而被消耗.一段时间后,试剂X将被反应生成的I2完全消耗.由于溶液中的I-继续被H2O2氧化,生成的I2与淀粉作用,溶液立即变蓝.因此,根据试剂X的量.滴入双氧水至溶液变蓝所需的时间,即可推算反应H2O2+2H++2I-→2H2O+I2的反应速率.
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
回答下列问题:
(1)已知:实验1.2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响.实验2中m=20.0,n=20.0
(2)一定温度下,H2O2+2H++2I-→2H2O+I2反应速率可以表示为v=k•ca(H2O2)•cb (I-)•c(H+)(k为常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=1.4min.
②根据上表数据可知,a.b的值依次为1和1.
(3)实验5表明:硫酸铁能提高反应速率.
①催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
②试用离子方程式表示Fe2(SO4)3对H2O2+2H++2I-→2H2O+I2催化的过程.(不必配平)
如表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编 号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1mol•L-1KI溶液 | 0.1mol•L-1H2O | X 0.1mol•L-1溶液 | 0.1mol•L-1双氧水 | 0.1mol•L-1稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 0 | 10.0 | 10.0 | 40.0 | 无 | t |
| 5 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1.2的目的是探究H2O2浓度对H2O2+2H++2I-→2H2O+I2反应速率的影响.实验2中m=20.0,n=20.0
(2)一定温度下,H2O2+2H++2I-→2H2O+I2反应速率可以表示为v=k•ca(H2O2)•cb (I-)•c(H+)(k为常数),则:
①实验4时,烧杯中溶液开始变蓝的时间t=1.4min.
②根据上表数据可知,a.b的值依次为1和1.
(3)实验5表明:硫酸铁能提高反应速率.
①催化剂能加快反应速率是因为催化剂降低(填“提高”或“降低”)了反应活化能.
②试用离子方程式表示Fe2(SO4)3对H2O2+2H++2I-→2H2O+I2催化的过程.(不必配平)
7.化学与生产,生活密切相关,下列有关说法中正确的是( )
| A. | 玻璃、水泥、水晶都是硅酸盐制品 | |
| B. | 将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理办法 | |
| C. | 石油的分馏和煤的气化、液化,涉及的都是物理变化 | |
| D. | 纤维素不能被人体消化吸收,但能促进肠道的蠕动,对人体有益 |
 (含位置)氮元素N,两个氢离子2H+,氧分子O2.
(含位置)氮元素N,两个氢离子2H+,氧分子O2.