题目内容
 A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题:
A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题:(1)A、B、C三种元素的第一电离能由大到小的顺序是
(2)D元素基态原子的价层电子排布图为
(3)白色晶体C3AB4可由CAB3和C2B在银皿中于300℃条件下制得,晶体C3AB4中阴离子的空间立体构型是
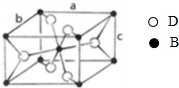
(4)B、D两种元素组成的某化合物晶体(金红石)晶胞结构如图所示,该化合物的化学式为
(5)已知D3+可形成配位数为6的配合物.现有组成皆为DCl3?6H2O的两种晶体,一种为绿色,另一种为紫色.为测定两种晶体的结构,分别取等量样品进行如下实验:①将晶体配成水溶液,②滴加足量AgNO3溶液,③过滤出AgCl沉淀并进行洗涤、干燥、称量;经实验测得产生的沉淀质量:绿色晶体是紫色晶体的
| 2 |
| 3 |
a.离子键 b.极性键 c.氢键 d.配位键.
考点:位置结构性质的相互关系应用,原子核外电子排布,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,元素周期律与元素周期表专题,化学键与晶体结构
分析:A、B、C、D四种元素的原子序数依次递增,A、B元素的基态原子L电子层中末成对电子数分别为3、2,则A原子核外电子排布式为1s22s22p3,A为氮元素;B的原子序数大于氮元素,则B原子核外电子排布式为1s22s22p4,B为氧元素;短周期主族元素中C元素的电负性最小,则C为Na元素;D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等,则D为Ti元素,据此解答.
解答:
解:A、B、C、D四种元素的原子序数依次递增,A、B元素的基态原子L电子层中末成对电子数分别为3、2,则A原子核外电子排布式为1s22s22p3,A为氮元素;B的原子序数大于氮元素,则B原子核外电子排布式为1s22s22p4,B为氧元素;短周期主族元素中C元素的电负性最小,则C为Na元素;D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等,则D为Ti元素,
(1)氮元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,结合金属性越强第一电离能越小,则第一电离能由大到小顺序是N>O>Na,
故答案为:N>O>Na;
(2)Ti元素原子核外电子数为22,其基态原子的价电子排布式是3d24s2,价层电子排布图为 故答案为:
故答案为: ;
;
(3)该白色晶体为Na3NO4,NO43-离子中N原子价层电子对数=4+
=4,N原子没有孤对电子,故其为正四面体结构,N原子采取sp3杂化;
原子总数与价电子总数相同的微粒即为等电子体,利用代换法,可知与NO43-离子互为等电子体的离子有:PO43-、SO42-、ClO4-等,分子有CCl4等;
故答案为:正四面体;sp3;SO42-等;CCl4;
(4)由图可知,晶胞中Ti原子位于体心与顶点上,O原子位于上下两个面上及体内(有2个),故晶胞中Ti元素数目=1+8×
=2、O原子数目=2+4×
=4,故该化合物化学式为TiO2,
晶胞质量=2×
g,若晶胞中a=b=460pm,c=300pm,则晶胞的体积=4.6×10-8cm×4.6×10-8cm×3×10-8cm=6.348×10-23cm3,该晶体的密度=
=
g/cm3,
故答案为:TiO2;
g/cm3;
(5)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子,即绿色晶体的化学式为[TiCl(H2O)5]Cl2?H2O,含有离子键、极性键、配位键,
故答案为:[TiCl(H2O)5]Cl2?H2O;abd.
(1)氮元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,结合金属性越强第一电离能越小,则第一电离能由大到小顺序是N>O>Na,
故答案为:N>O>Na;
(2)Ti元素原子核外电子数为22,其基态原子的价电子排布式是3d24s2,价层电子排布图为
 故答案为:
故答案为: ;
;(3)该白色晶体为Na3NO4,NO43-离子中N原子价层电子对数=4+
| 5+3-2×4 |
| 2 |
原子总数与价电子总数相同的微粒即为等电子体,利用代换法,可知与NO43-离子互为等电子体的离子有:PO43-、SO42-、ClO4-等,分子有CCl4等;
故答案为:正四面体;sp3;SO42-等;CCl4;

(4)由图可知,晶胞中Ti原子位于体心与顶点上,O原子位于上下两个面上及体内(有2个),故晶胞中Ti元素数目=1+8×
| 1 |
| 8 |
| 1 |
| 2 |
晶胞质量=2×
| 80 |
| NA |
2×
| ||
| 6.348×10-23cm3 |
| 160 |
| 6.348×10-23NA |
故答案为:TiO2;
| 160 |
| 6.348×10-23NA |
(5)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
故答案为:[TiCl(H2O)5]Cl2?H2O;abd.
点评:本题物质结构与性质,涉及核外电子排布、电离能、杂化轨道与微粒结构、等电子体、晶胞计算、配合物等,推断元素是解题关键,注意掌握等电子体的概念,注意配合物中内界离子与外界离子的区别,难度中等.

练习册系列答案
相关题目
有下列物质:①标准状况下11.2L H2②4℃时10g H2O ③0.2mol H3PO4④6.8g NH3,按所含的分子数由多到少的顺序排列正确的是( )
| A、②①④③ | B、④③②① |
| C、①②④③ | D、①②③④ |