题目内容
在标准状况下,对A和B两种物质组成的混合气体(A的相对分子质量大于B)进行分析,已知混合气体中只有氮和氧,而且不论A、B以何种比例混合,氮和氧的质量比总大于7:8,小于7:4,由此可确定A为 ,B为 (写化学式).若上述气体中氮和氧质量比为21:20,则混合气体中A和B的物质的量之比为 .
考点:物质的量的相关计算
专题:计算题
分析:混合气体中只有氮和氧,氮和氧的质量比为7:8时,原子个数比为
:
=1:1;质量比为7:4时,原子个数比为
:
=2:1,以此分析混合物组成,进一步利用元素质量比计算.
| 7 |
| 14 |
| 8 |
| 16 |
| 7 |
| 14 |
| 4 |
| 16 |
解答:
解:混合气体中只有氮和氧,氮和氧的质量比为7:8时,原子个数比为
:
=1:1;质量比为7:4时,原子个数比为
:
=2:1,
即混合气体中原子个数大于1:1,小于2:1,A的相对分子质量大于B,则A为N2O,B为NO,
气体中氮和氧质量比为21:20,设N2O、NO的物质的量分别为x、y,
则
=
,解得x:y=1:4,
故答案为:N2O;NO;1:4.
| 7 |
| 14 |
| 8 |
| 16 |
| 7 |
| 14 |
| 4 |
| 16 |
即混合气体中原子个数大于1:1,小于2:1,A的相对分子质量大于B,则A为N2O,B为NO,
气体中氮和氧质量比为21:20,设N2O、NO的物质的量分别为x、y,
则
| 2x×14+y×14 |
| 16x+16y |
| 21 |
| 20 |
故答案为:N2O;NO;1:4.
点评:本题考查物质的量的计算,为基础性习题,把握元素的质量比及原子个数比的关系为解答的关键,侧重分析能力和计算能力的考查,题目较简单.

练习册系列答案
相关题目
下列溶液中Cl-的物质的量浓度与50mL 1mol?L-1 AlCl3溶液中Cl-的物质的量浓度相等的是( )
| A、150mL 1mol?L-1的NaCl溶液 |
| B、50mL 1mol?L-1的CaCl2溶液 |
| C、150mL 3mol?L-1的KCl溶液 |
| D、150mL 3mol?L-1的MgCl2溶液 |
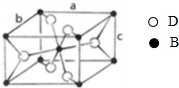 A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题:
A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题: