题目内容
如果0.22mol Cu2S与某浓度硝酸恰好完全反应,反应后把溶液小火蒸干,得到固体混合物108.24g,已知其中一种固体是胆矾,则另一固体的化学式为 .
考点:化学方程式的有关计算
专题:计算题
分析:0.22mol Cu2S与硝酸发生氧化还原反应,设生成CuSO4为xmol,发生氧化还原反应一定生成硝酸铜,结合Cu原子守恒及质量关系计算.
解答:
解:0.22mol Cu2S与硝酸发生氧化还原反应,设生成CuSO4为xmol,Cu(NO3)2为ymol,则CuSO4.5H2O为xmol,
发生氧化还原反应一定生成硝酸铜,由Cu原子守恒及质量可知,
,
解得x=0.0284mol,y=0.0156mol,
符合题意,即另一固体为Cu(NO3)2,
故答案为:Cu(NO3)2.
发生氧化还原反应一定生成硝酸铜,由Cu原子守恒及质量可知,
|
解得x=0.0284mol,y=0.0156mol,
符合题意,即另一固体为Cu(NO3)2,
故答案为:Cu(NO3)2.
点评:本题考查氧化还原反应的计算,为高频考点,把握Cu、S元素被硝酸氧化时,除生成硫酸铜还可生成硝酸铜,利用计算验证即可,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
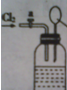 向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:
向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:
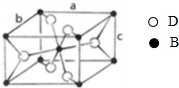 A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题:
A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题: