题目内容
反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,标准状况下若有11.2L Cl2生成,则
(1)被氧化的HCl物质的量为 .
(2)电子转移的数目为 .
(1)被氧化的HCl物质的量为
(2)电子转移的数目为
考点:氧化还原反应的计算,氧化还原反应
专题:氧化还原反应专题
分析:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,10molHCl中10molHCl作还原剂,以此来解答.
解答:
解:标准状况下若有11.2L Cl2生成,n(Cl2)=
=0.5mol,
(1)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O~被氧化的10HCl
5 10
0.5mol x
=
,解得x=1mol,
故答案为:1mol;
(2)电子转移的数目为0.5mol×2×1×NA=NA,故答案为:NA.
| 11.2L |
| 22.4L/mol |
(1)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O~被氧化的10HCl
5 10
0.5mol x
| 5 |
| 10 |
| 0.5mol |
| x |
故答案为:1mol;
(2)电子转移的数目为0.5mol×2×1×NA=NA,故答案为:NA.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重计算能力、分析能力的考查,题目难度不大.

练习册系列答案
相关题目
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原溶液中Mg2+、Al3+的物质的量浓度之比为( )


| A、1:2 | B、2:1 |
| C、1:1 | D、2:3 |
下列各组物质中为同分异构体的是( )
| A、1H与2H |
| B、O2与O3 |
| C、乙烯与丙烯 |
| D、异戊烷与新戊烷 |
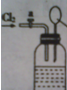 向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:
向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解: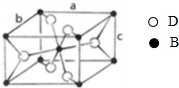 A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题:
A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属”,其基态原子外围电子占据两个能级且各能级电子数相等.请回答下列问题: