题目内容
2.现将淀粉胶体和Na2SO4的混合溶液装在半透膜中,浸泡在盛蒸馏水的烧杯内,下列说法中能证明半透膜完好无损的是( )| A. | 取烧杯内液体,加入BaCl2溶液产生白色沉淀 | |
| B. | 取烧杯内液体,加入碘水不变蓝 | |
| C. | 取半透膜内液体,加入BaCl2溶液没有白色沉淀 | |
| D. | 取半透膜内液体,加入碘水变蓝 |
分析 胶体粒子不能通过半透膜,而且其它小分子或离子可以通过半透膜,故要证明半透膜完好无损,需证明烧杯中液体无淀粉,可用碘水检验.
解答 解:因淀粉是胶体,不能透过半透膜,则只要袋子不破损,淀粉就不会出来,即取烧杯中液体,加入碘水不变蓝,则证明没有淀粉出来,则能证明半透膜完好无损,故选B.
点评 本题考查了胶体性质,胶体的透性,根据实验考查了学生分析问题,解决问题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.随着公路上汽车流量的迅速增长,交通事故频繁发生.汽车安全气囊是在发生撞车时、产生二次碰撞前能够自动膨胀保护乘员的装置,碰撞时发生反应:10NaN3+2KNO3→K2O+5Na2O+16N2↑.下列判断正确的是( )
| A. | N2既是氧化剂又是还原剂 | |
| B. | NaN3中N元素被还原 | |
| C. | 还原产物与氧化产物质量之比为l:15 | |
| D. | 每生成16molN2转移30mole |
13.醛可发生分子间的反应,生成烃基醛,如
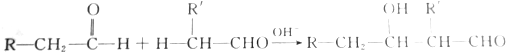
现在用甲醛和乙醛来制备季戊四醇[C(CH2OH)4],消耗的甲醛与乙醛的物质的量之比为( )
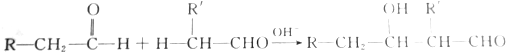
现在用甲醛和乙醛来制备季戊四醇[C(CH2OH)4],消耗的甲醛与乙醛的物质的量之比为( )
| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
10.下列离子方程式书写正确的是( )
| A. | 石灰石与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液中滴加硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 硫酸铜溶液与烧碱溶液反应:Cu2++2OH-═Cu(OH)2↓ |
7.下列反应中,盐酸既表现出还原性又表现出酸性的是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | Fe+2HCl═FeCl2+H2↑ | ||
| C. | MnO2+4HCl (浓)═MnCl2+Cl2↑+2H2O | D. | NaOH+HCl═NaCl+H2O |
14.25℃时,对有关溶液的分析不正确的是( )
| A. | 将0.1mol•L-1Na2CO3溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| B. | pH=2的醋酸溶液与pH=12的氢氧化钠溶液中水的电离程度相同 | |
| C. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液中c(Na+):①>②>③ | |
| D. | CH3COONa和CaCl2混合溶液:c(Na-)+2c(Ca-)═c(CH3COO-)+c(CH3COOH)+c(Cl-) |
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.