题目内容
14.25℃时,对有关溶液的分析不正确的是( )| A. | 将0.1mol•L-1Na2CO3溶液加水稀释后,溶液中n(H+)•n(OH-)不变 | |
| B. | pH=2的醋酸溶液与pH=12的氢氧化钠溶液中水的电离程度相同 | |
| C. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液中c(Na+):①>②>③ | |
| D. | CH3COONa和CaCl2混合溶液:c(Na-)+2c(Ca-)═c(CH3COO-)+c(CH3COOH)+c(Cl-) |
分析 A.n(H+)•n(OH-)=c(H+)×V×c(OH-)×V,根据浓度与体积变化分析;
B.酸碱都抑制水的电离,氢离子和氢氧根离子浓度浓度相同时,对水的抑制程度相同;
C.pH相同时,盐的酸根离子水解程度越大,盐溶液的浓度越小;
D.根据物料守恒分析.
解答 解:A.n(H+)•n(OH-)=c(H+)×V×c(OH-)×V,由于温度不变,所以c(H+)×c(OH-)的值不变,而体积增大,所以n(H+)•n(OH-)增大,故A错误;
B.酸碱都抑制水的电离,氢离子和氢氧根离子浓度浓度相同时,对水的抑制程度相同,已知pH=2的醋酸溶液中氢离子浓度为0.01mol/L,pH=12的氢氧化钠溶液中氢氧根离子的浓度为0.01mol/L,所以两种溶液对水的抑制程度相同,故B正确;
C.pH相同时,盐的酸根离子水解程度越大,盐溶液的浓度越小,水解程度:①<②<③,所以溶液的浓度①>②>③,则三种溶液中c(Na+):①>②>③,故C正确;
D.CH3COONa中物料守恒为:c(Na-)═c(CH3COO-)+c(CH3COOH);CaCl2溶液中物料守恒为2c(Ca-)═c(Cl-),所以CH3COONa和CaCl2混合溶液:c(Na-)+2c(Ca-)═c(CH3COO-)+c(CH3COOH)+c(Cl-),故D正确.
故选A.
点评 本题考查了盐的水解原理、溶液中物料守恒的分析应用等,题目难度中等,侧重于考查学生的分析能力,注意把握盐溶液对水的电离平衡的影响.

练习册系列答案
相关题目
4.下列各项中物质的类别和用途对应关系不正确的是( )
| A | B | C | D |
| A12O3 | Si | Na2O2 | Na2SiO3 |
| 两性氧化物 | 单质 | 碱性氧化物 | 正盐 |
| 工业用电解法冶炼铝 | 制作太阳能电池 | 用于呼吸面具作为氧气的来源 | 制备硅胶 |
| A.A | B.B | C.C | D.D |
5.下列离子方程式正确的是( )
| A. | 硫酸铜和铝:2Al+3Cu2+═3Cu+2Al3+ | |
| B. | 氧化铜与盐酸反应:O2-+2H+═H2O | |
| C. | 碳酸钡与盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | Cu(OH)2加入H2SO4:2H++Cu(OH)2═Cu2++2H2O |
2.现将淀粉胶体和Na2SO4的混合溶液装在半透膜中,浸泡在盛蒸馏水的烧杯内,下列说法中能证明半透膜完好无损的是( )
| A. | 取烧杯内液体,加入BaCl2溶液产生白色沉淀 | |
| B. | 取烧杯内液体,加入碘水不变蓝 | |
| C. | 取半透膜内液体,加入BaCl2溶液没有白色沉淀 | |
| D. | 取半透膜内液体,加入碘水变蓝 |
3.化学无处不在,下列与化学有关的说法正确的是( )
| A. | SO2能漂白纸浆等,故可广泛用于食品的漂白. | |
| B. | 烹调鱼时加入少量料酒和食醋可以减少腥味、增加香味 | |
| C. | 工业上用电解熔融的AlCl3来制取铝单质 | |
| D. | 制作航天服的聚酯纤维和用于光纤通信的光导纤维都是新型无机非金属材料 |
19.体积为V mL,密度为ρg•cm-3的溶液,含有摩尔质量为M g•mol-1的溶质m g,其物质的量浓度为c mol/L,溶质的质量分数为W%,则下列表示式中正确的是( )
| A. | c=$\frac{W•1000•ρ}{M}$ | B. | m=V•ρ•$\frac{W}{100}$ | C. | W%=$\frac{c×M}{1000×ρ}$% | D. | c=$\frac{m}{V•M}$ |

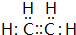 ,实验室制备该气体的化学方程式为CH3CH2OH$→_{浓硫酸}^{170℃}$C2H4↑+H2O
,实验室制备该气体的化学方程式为CH3CH2OH$→_{浓硫酸}^{170℃}$C2H4↑+H2O