题目内容
6.短周期元素A、B、C的原子序数依次增大,其族序数之和为13,且C的族序数是B的族序数的3倍.下列说法正确的是( )| A. | 三种元素的原子半径:B最小 | |
| B. | 最高价氧化物对应的水化物:仅B呈碱性 | |
| C. | 常温下,B在A、C的最高价氧化物对应的水化物浓溶液中会发生钝化 | |
| D. | A、B、C的氧化物都是形成酸雨的罪魁祸首 |
分析 短周期元素A、B、C的原子序数依次增大,其族序数之和为13,且C的族序数是B的族序数的3倍,则B为ⅡA族元素,C为ⅥA族元素,可知A为ⅤA族元素,由原子序数关系可知A为N元素,B为Mg元素,C为S元素,以此解答该题.
解答 解:短周期元素A、B、C的原子序数依次增大,其族序数之和为13,且C的族序数是B的族序数的3倍,则B为ⅡA族元素,C为ⅥA族元素,可知A为ⅤA族元素,由原子序数关系可知A为N元素,B为Mg元素,C为S元素,
A.原子核外电子层数越多,原子半径越大,N的原子半径最小,Mg的最大,故A错误;
B.B为Mg,A为N,C为S,对应的最高价氧化物对应的水化物只有B为碱性,故B正确;
C.Mg与浓硫酸、浓硝酸不发生钝化反应,故C错误;
D.MgO不会形成酸雨,故D错误.
故选B.
点评 本题考查结构性质位置关系应用,为高考常见题型,推断元素是解题关键,侧重考查学生分析推理能力以及对元素周期律的考查,难度中等.

练习册系列答案
相关题目
17.充分燃烧1mol气态烃R,得到标准状况下44.8LCO2和54gH2O,则R是( )
| A. | C2H6 | B. | C2H4 | C. | C2H2 | D. | C4H6 |
14.化合物G(结构如图)是合成抗癌药氨柔比星的中间体.下列说法正确的是( )
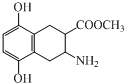

| A. | 该有机物的分子式为C12H14NO4 | |
| B. | 该有机物既可与盐酸反应,又可与NaOH溶液反应 | |
| C. | 该有机物中含有2个手性碳原子 | |
| D. | 1mol该有机物最多只能与1molBr2发生取代反应 |
6.在标准状况下,气体摩尔体积约为22.4L/mol,则标准状况下1.5molH2的体积约为( )
| A. | 44.8L | B. | 5L | C. | 11.2L | D. | 33.6L |
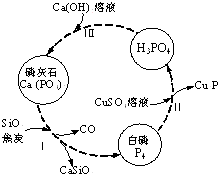 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.
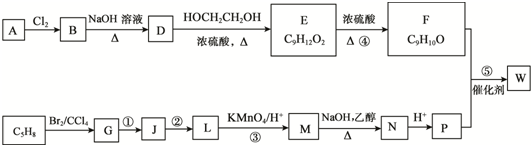
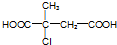 .
. (R1~R4表示烃基)
(R1~R4表示烃基) .
.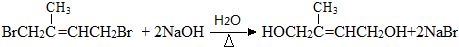 .
. .
. .
.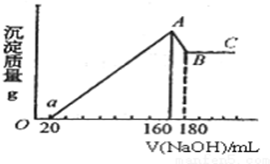 将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.
将一定量的Mg、Al投入100mL一定的物质的量浓度的盐酸中,合金全部溶解.向所得溶液中滴加5mol/L的NaOH至过量,生成的沉淀的质量与加入NaOH的体积的关系如图所示.