题目内容
16.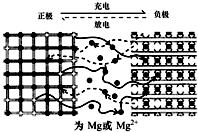 镁离子电池以金属镁或镁合金为负极,以能嵌入镁离子的化合物为正极,其工作原理如图所示,反应原理为:xMg+Mo3S4$?_{充电}^{放电}$ MgxMo3S4,下列说法不正确的是( )
镁离子电池以金属镁或镁合金为负极,以能嵌入镁离子的化合物为正极,其工作原理如图所示,反应原理为:xMg+Mo3S4$?_{充电}^{放电}$ MgxMo3S4,下列说法不正确的是( )| A. | 放电时,电池中的Mg2+从负极移向正极 | |
| B. | 其负极反应为:xMg-2xe-+Mo3S42x-═MgxMo3S4 | |
| C. | 充电时阳极反应式:MgxMo3S4-2xe-═Mo3S4+xMg2+ | |
| D. | 由于镁的密度较小,且Mg2+携带两个正电荷,这为高能量电池的设计提供了一个可靠依据 |
分析 由总反应式可知,放电时,为原电池反应,Mg化合价升高,被氧化,电极反应式为xMg-2xe-=xMg2+,Mo3S4被还原,为原电池正极反应,电极反应式为Mo3S4+2xe-=Mo3S42x-,充电是电能转化为化学能的过程,阳极反应和原电池正极相连,发生氧化反应,电极反应为MgxMo3S4-2xe-═Mo3S4+xMg2+.
解答 解:A.放电时,为原电池原理,阳离子向正极移动,故Mg2+向正极极移动,故A正确;
B.放电时,为原电池反应,Mg化合价升高,被氧化,电极反应式为xMg-2xe-=xMg2+,故B错误;
C.充电时,阳极反应和原电池正极相连,发生氧化反应,电极反应为MgxMo3S4-2xe-═Mo3S4+xMg2+,故C正确;
D.镁的密度较小,且Mg2+携带两个正电荷,密度小能量高,为高能量电池的设计提供了一个可靠依据,故D正确;
故选B.
点评 本题考查原电池与电解池知识,题目难度中等,注意根据电池总反应书写电极反应式,此为解答该题的关键,学习中注意体会书写方法.

练习册系列答案
相关题目
6.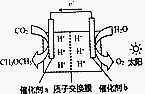 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
 模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )
模拟植物的光合作用,利用太阳能将H2O和CO2化合生成二甲醚(CH3OCH3),装置如图所示,下列说法错误的是( )| A. | H+由交换膜右侧向左侧迁移 | |
| B. | 催化剂a表面发生的反应是2CO2+12e-+12H+═CH3OCH3+3H2O | |
| C. | 该过程是太阳能转化为化学能的过程 | |
| D. | 消耗CO2与生成O2体积比为1:1 |
7.下列说法正确的是( )
| A. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 | |
| B. | 75%的酒精可使蛋白质变性从而起到消毒作用 | |
| C. | 纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 | |
| D. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 |
4.下列实验操作正确的是( )


| A. | 用pH试纸测定浓硫酸的pH | |
| B. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| C. | 用甲图装置验证FeCl3对H2O2分解反应有催化作用 | |
| D. | 用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
1.短周期主族元素X、Y、Z、W的原子序数依次增大.其中X、Z同主族,Z的单质是一种良好的半导体材料,Y元素原子最外层电子数等于其电子层数,W是同周期中原子半径最小的元素.下列叙述正确的是( )
| A. | Y的简单离子半径小于W的简单离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Z的气态简单氢化物的稳定性比X的强 |
8.如图1所示是实验室中制取气体的一种简易装置.
(1)请简述检验它的气密性的方法关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好.
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)不溶于水的块状固体、不需要加热而反应生成的气体.
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.

(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为2.95mol/L(计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和量筒.
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH$\stackrel{高温}{→}$2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是d.
a.HNO3的氧化性比KNO3弱 b.反应的温度不够
c.HNO3的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等.请设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
(1)请简述检验它的气密性的方法关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好.
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)不溶于水的块状固体、不需要加热而反应生成的气体.
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.

(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为2.95mol/L(计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和量筒.
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH$\stackrel{高温}{→}$2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是d.
a.HNO3的氧化性比KNO3弱 b.反应的温度不够
c.HNO3的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等.请设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
6.经过长时间的努力已经可以解决部分的污染问题,例如可降解塑料的问世,聚二氧化碳塑料就是其中的佼佼者,有关聚二氧化碳塑料的说法正确的是( )
| A. | 聚二氧化碳塑料是通过缩聚反应生成的 | |
| B. | 聚二氧化碳塑料的结构式可表示为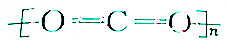 | |
| C. | 聚二氧化碳塑料属于纯净物,相对分子质量为44n | |
| D. | 聚二氧化碳塑料是属于环境友好材料 |
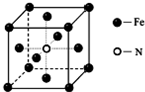 NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.
NH3在工农业生产中具有重要的作用,可以用来生产尿素等化学肥料,也可以用来制备一些配位化合物.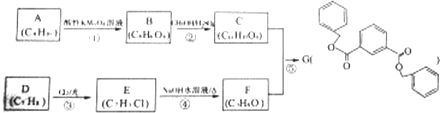
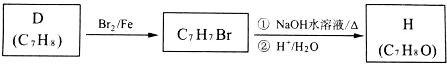
 .
.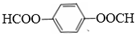 .
.