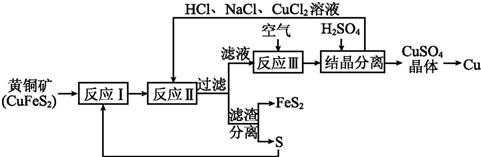
题目内容
8. 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.(1)镓的基态原子的电子排布式是1s22s22p63s23p63d104s24p1.
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为Br>As>Se(用元素符号表示).
(3)气态SeO3分子的立体构型为平面三角形.
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:硅烷的相对分子质量越大,分子间范德华力越强.
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的原子杂化类型为sp3.
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应生成铜氨配离子的溶液,则该反应的离子方程式为Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O.
(7)一种铜金合金晶体具有面心立方最密堆积的结构.在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为1:3,若该晶胞的边长为a pm,则合金的密度为$\frac{197+64×3}{{N}_{A}×(a×1{0}^{-10})^{3}}$g•cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
分析 (1)镓是31号元素,根据原子核外电子排布规律可以写出电子排布式;
(2)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
(3)计算SeO3分子中Se原子的价层电子对数、孤对电子数,可以判断分子构型;
(4)硅烷(SinH2n+2)都是分子晶体,相对分子质量越大,分子间作用力越强,晶体沸点越高;
(5)[B(OH)4]-中B的价层电子对=4+$\frac{1}{2}$×(3+1-4×1)=4,杂化轨道数目为4;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子Cu(NH3)42+,两者相互促进使反应进行;
(7)利用均摊法确定晶胞中各种原子的个数,结合晶胞中原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算密度;
解答 解:(1)镓是31号元素,核外电子排布式为:1s22s22p63s23p63d104s24p1,
故答案为:1s22s22p63s23p63d104s24p1;
(2)砷、硒、溴三种元素都是第4周期非金属元素,同一周期元素自左而右第一电离能呈增大趋势,但砷元素原子4p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能Br>As>Se,故答案为:Br>As>Se;
(3)气态SeO3分子中中心原子的价层电子对数为3+$\frac{6-2×3}{2}$=3,无孤电子对,所以分子构型为平面三角形,
故答案为:平面三角形;
(4)硅烷(SinH2n+2)都是分子晶体,分子晶体的沸点高低取决于分子间作用力,而分子间作用力与相对分子质量的大小有关,硅烷的相对分子质量越大,分子间范德华力越强,晶体的沸点越高,
故答案为:硅烷的相对分子质量越大,分子间范德华力越强;
(5)[B(OH)4]-中B的价层电子对=4+$\frac{1}{2}$(3+1-4×1)=4,所以采取sp3杂化,
故答案为:sp3;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,说明两者能互相促进,是两种物质共同作用的结果,其中过氧化氢为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行,方程式可表示为:Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O,
故答案为:Cu+H2O2+4NH3•H2O=Cu(NH3)42++2OH-+4H2O;
(7)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×$\frac{1}{8}$=1,Cu原子个数=6×$\frac{1}{2}$=3,所以该合金中Au原子与Cu原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=$\frac{\frac{197+64×3}{{N}_{A}}g}{(a×1{0}^{-10}cm)^{3}}$=$\frac{197+64×3}{{N}_{A}×(a×1{0}^{-10})^{3}}$g•cm-3,
故答案为:1:3;$\frac{197+64×3}{{N}_{A}×(a×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、第一电离能、分子空间构型、杂化方式、晶胞计算,注意理解同周期第一电离能异常情况,难度中等.

| A. |  | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 溶液中导电粒子的数目增加 | |
| D. | 再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
| A. | H2+Cl2═2HCl | B. | CuO+2H+═Cu2++H2O | ||
| C. | H2O+CaO═Ca(OH)2 | D. | NaOH+HCl═H2O+NaCl |
| A. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S+2H2O | |
| C. | 氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O | |
| D. | 向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++4OH-═${AlO}_{2}^{-}$+2H2O |
| A. | 常温常压下,17 g ND3中所含分子数目NA | |
| B. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA |
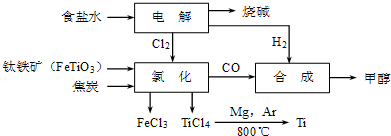
请回答下列问题:
(1)Ti的原子序数为22,Ti位于元素周期表中第四周期,第ⅣB族;
(2)写出钛铁矿在高温下与焦炭、氯气反应得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO;
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•xH2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因由TiCl4+(2+x)H2O
 TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;(4)由TiCl4→Ti需要在Ar气中进行的理由是防止钛、镁被氧化;反应后得到Mg、MgCl2、Ti的混合物,可采用蒸馏(填分离方法)得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(1)纯水在100℃时,pH=6,该温度下0.1mol•L-1的NaOH溶液中,溶液的pH=11.
(2)25℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为CO32-+H2O=HCO3-+OH-、HCO3-+H2O?H2CO3+OH-,由水电离出的c(OH-)=10-3 mol•L-1.
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②25℃时,在0.5mol/L 的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的9×108倍.
| A. | H2SO4溶液 | B. | AgNO3溶液 | C. | NaOH溶液 | D. | KSCN溶液 |