题目内容
用NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A、1g水中含氧原子数为 NA/18 |
| B、NA个CO2分子和NA个CO分子质量比为11:7 |
| C、18g水中含电子数为8NA个 |
| D、1mol Fe2+带2NA个正电荷 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、求出水的物质的量,然后根据1mol水中含1mol氧原子来分析;
B、物质的量相同的物质的质量之比等于其摩尔质量之比;
C、求出水的物质的量,然后根据1mol水中含10mol电子来分析;
D、1mol Fe2+中带2mol正电荷.
B、物质的量相同的物质的质量之比等于其摩尔质量之比;
C、求出水的物质的量,然后根据1mol水中含10mol电子来分析;
D、1mol Fe2+中带2mol正电荷.
解答:
解:A、1g水的物质的量为
mol,而1mol水中含1mol氧原子,故
mol水中含
mol氧原子,故A正确;
B、NA个CO2分子和NA个CO分子的物质的量相同,其质量之比等于其摩尔质量之比,故质量之比为44:28=11:7,故B正确;
C、18g水的物质的量为1mol,而1mol水中含10mol电子,故C错误;
D、Fe2+为+2价,1mol Fe2+中带2mol正电荷,故D正确.
故选C.
| 1 |
| 18 |
| 1 |
| 18 |
| 1 |
| 18 |
B、NA个CO2分子和NA个CO分子的物质的量相同,其质量之比等于其摩尔质量之比,故质量之比为44:28=11:7,故B正确;
C、18g水的物质的量为1mol,而1mol水中含10mol电子,故C错误;
D、Fe2+为+2价,1mol Fe2+中带2mol正电荷,故D正确.
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
将氯气转变为漂白粉的主要目的是( )
①使它转变为较易溶于水的物质;②转变为较稳定、便于贮存的物质;③提高氯的质量分数;④提高漂白能力.
①使它转变为较易溶于水的物质;②转变为较稳定、便于贮存的物质;③提高氯的质量分数;④提高漂白能力.
| A、①② | B、②③④ | C、②③ | D、② |
已知:①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1;②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ?mol-1.下列说法中错误的是( )
| A、①式表示25℃,101 kPa时,2mol H2和1mol O2完全燃烧生成2mol H2O(l)放热571.6kJ |
| B、2H2(g)+O2(g)═2H2O(g)中△H大于-571.6 kJ?mol-1 |
| C、将含1molNaOH的水溶液与50g98%的硫酸混合后放出的热量为57.3kJ |
| D、将含1molNaOH的稀溶液与含1mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ |
设阿伏加德罗常数的数值为NA,下列说法正确的是(相对原子质量:H-1、O-16)( )
| A、11.2LNH3所含分子数为0.5nA |
| B、常温下,34gH2O2中H-O键数目为2nA |
| C、100ml1mol/LFeCl3溶液中含Fe3+微粒的数目是0.1nA |
| D、1molCl2与足量Fe反应,转移的电子数为3nA |
下列分散系属于胶体的是( )
| A、净水剂在水中形成的分散系 |
| B、食盐水 |
| C、石灰乳 |
| D、碘酒 |
已知X、Y为短周期元素,可形成原子数比为1:3的化合物,若Y的原子序数为m,则x的原子序数为:①m+4;②m-4;③m+8;④m-2;⑤m+6;⑥m+5其中正确的是( )
| A、②④⑤⑥ | B、①②④⑤⑥ |
| C、①②③④⑤ | D、全部 |

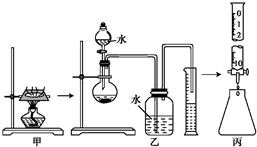 某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题:
某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题: