题目内容
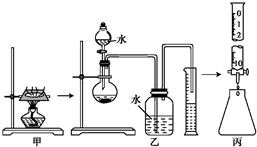 某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题:
某研究性学习小组对“钠在空气中燃烧的产物”进行了探究.其实验过程为:取一小块钠在空气中加热片刻后与一定量的水反应,收集到V mL(标准状况)气体,向所得溶液中滴入1.000mol?L-1的盐酸溶液30.00mL恰好中和完全.实验装置如图所示.试回答下列问题:(1)甲、乙、丙三套装置共有
(2)丙的操作中,若以酚酞作指示剂,滴定终点时锥形瓶内溶液颜色的变化是
(3)若V=168,在一定条件下将其引燃,恰好完全反应.请将钠块在空气中加热片刻后所得到的固体成分及其质量填入下表:(表格可不填满也可补充)
| 成分 | |||
| 质量/g |
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)分液漏斗的瓶塞没有打开,无法流出水;排水法测量气体体积时,进气管应该短、出气管长;消耗了30.00mL盐酸,应该使用50ml的酸式滴定管;
(2)滴定结束前溶液为红色,滴定结束后溶液变成无色,据此判断滴定终点;
(3)钠在空气中加热反应生成过氧化钠、氧化钠,过氧化钠与水反应生成氧气,钠与水反应生成氢氧化钠和氢气,依据盐酸与氢氧化钠反应结合钠原子个数守恒计算生成氢氧化钠的物质的量,依据产生氢气与氧气在适当条件下点燃,恰好完全反应,结合方程式计算钠和过氧化钠的质量.
(2)滴定结束前溶液为红色,滴定结束后溶液变成无色,据此判断滴定终点;
(3)钠在空气中加热反应生成过氧化钠、氧化钠,过氧化钠与水反应生成氧气,钠与水反应生成氢氧化钠和氢气,依据盐酸与氢氧化钠反应结合钠原子个数守恒计算生成氢氧化钠的物质的量,依据产生氢气与氧气在适当条件下点燃,恰好完全反应,结合方程式计算钠和过氧化钠的质量.
解答:
解:(1)乙装置中分液漏斗的瓶塞应该打开,否则水无法流出;集气瓶中导气管应该进气管短、出气管长,才能够排水测量气体体积;丙装置中滴定管应该选用50mL的滴定管,所以有3处错误,
故答案为:三;
(2)丙的操作中,若以酚酞作指示剂,滴定结束前溶液显示碱性,则溶液为红色,恰好反应时溶液为中性,则溶液变为无色,所以滴定终点时锥形瓶内溶液颜色的变化为:浅红色或红色变成无色,且半分钟内不变色,
故答案为:浅红色或红色变成无色,且半分钟内不变色;
(3)解:设反应后的固体中钠物质的量为xmol,过氧化钠的物质的量为ymol,氧化钠的质量为z;
收集到气体体积n=
=0.0075mol;消耗盐酸的物质的量为:n(HCl)=1.00mol?L-1×0.03L=0.03mol,
设钠的物质的量为x,过氧化钠的物质的量为y,氧化钠的物质的量为zmol,
钠与水反应方程式:2Na+2H2O=2NaOH+H2↑,
2 2 1
x x 0.5x
过氧化钠与水反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,
2 4 1
y 2y 0.5y
根据气体总物质的量可得:①0.5x+0.5y=0.0075mol;
氧化钠与水反应:Na2O+H2O=2NaOH,
1 2
z 2z
氢氧化钠与盐酸反应方程式:NaOH+HCl=NaCl+H2O,
1 1
x+2y x+2y+2z
则:②x+2y+2z=0.03mol,
氢气与氧气反应的方程式:2H2+O2=2H2O;
2 1
0.5x 0.5y
气体恰好反应,则:③0.5x:0.5y=2:1,
联立①②③解得:x=0.01mol、y=0.005mol、z=0.05mol,
则钠的质量为:0.01mol×23g/mol=0.23g,
过氧化钠的质量为:0.005mol×78g/mol=0.39g,
氧化钠的质量为:0.005mol×62g/mol=0.31g,
故答案为:
.
故答案为:三;
(2)丙的操作中,若以酚酞作指示剂,滴定结束前溶液显示碱性,则溶液为红色,恰好反应时溶液为中性,则溶液变为无色,所以滴定终点时锥形瓶内溶液颜色的变化为:浅红色或红色变成无色,且半分钟内不变色,
故答案为:浅红色或红色变成无色,且半分钟内不变色;
(3)解:设反应后的固体中钠物质的量为xmol,过氧化钠的物质的量为ymol,氧化钠的质量为z;
收集到气体体积n=
| 0.168L |
| 22.4L/mol |
设钠的物质的量为x,过氧化钠的物质的量为y,氧化钠的物质的量为zmol,
钠与水反应方程式:2Na+2H2O=2NaOH+H2↑,
2 2 1
x x 0.5x
过氧化钠与水反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,
2 4 1
y 2y 0.5y
根据气体总物质的量可得:①0.5x+0.5y=0.0075mol;
氧化钠与水反应:Na2O+H2O=2NaOH,
1 2
z 2z
氢氧化钠与盐酸反应方程式:NaOH+HCl=NaCl+H2O,
1 1
x+2y x+2y+2z
则:②x+2y+2z=0.03mol,
氢气与氧气反应的方程式:2H2+O2=2H2O;
2 1
0.5x 0.5y
气体恰好反应,则:③0.5x:0.5y=2:1,
联立①②③解得:x=0.01mol、y=0.005mol、z=0.05mol,
则钠的质量为:0.01mol×23g/mol=0.23g,
过氧化钠的质量为:0.005mol×78g/mol=0.39g,
氧化钠的质量为:0.005mol×62g/mol=0.31g,
故答案为:
| 成分 | Na2O | Na | Na2O2 |
| 质量/g | 0.31 | 0.23 | 0.39 |
点评:本题考查了探究物质组成的实验,题目难度中等,明确化学实验基本操作方法及中和滴定原理为解答关键,试题侧重考查学生的分析、理解能力及化学实验能力,(3)为难点,注意发生反应原理及化学计算方法.

练习册系列答案
相关题目
下列反应中,氧化剂与还原剂物质的量的关系为2:1的是 ( )
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH(醋酸)+Ca(ClO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NaIO3+Cl2 |
| D、4HCl(浓)+MnO2=△=MnCl2+Cl2↑+2H2O |
用NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A、1g水中含氧原子数为 NA/18 |
| B、NA个CO2分子和NA个CO分子质量比为11:7 |
| C、18g水中含电子数为8NA个 |
| D、1mol Fe2+带2NA个正电荷 |
原子个数相等、电子数也相等的微粒叫等电子体,下列各微粒属于等电子体的是( )
| A、N2O4和 NO2 |
| B、CO和 N2 |
| C、CO2 和NO2 |
| D、NH4+ 和HS- |
发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气.已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ/mol;N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是( )
下列关于肼和NO2反应的热化学方程式中,正确的是( )
| A、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7kJ/mol | ||
| B、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1000.3kJ/mol | ||
C、N2H4(g)+NO2(g)=
| ||
| D、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ/mol |
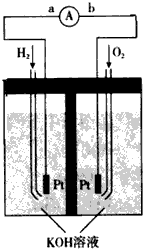 (1)氢氧燃料电池的能量转化主要形式是
(1)氢氧燃料电池的能量转化主要形式是