题目内容
设阿伏加德罗常数的数值为NA,下列说法正确的是(相对原子质量:H-1、O-16)( )
| A、11.2LNH3所含分子数为0.5nA |
| B、常温下,34gH2O2中H-O键数目为2nA |
| C、100ml1mol/LFeCl3溶液中含Fe3+微粒的数目是0.1nA |
| D、1molCl2与足量Fe反应,转移的电子数为3nA |
考点:阿伏加德罗常数
专题:
分析:A、氨气所处的状态不明确;
B、求出H2O2的物质的量,然后根据1molH2O2中含2molH-O键来分析;
C、Fe3+是弱碱阳离子,在溶液中会水解;
D、反应中氯元素的价态由0降低为-1价.
B、求出H2O2的物质的量,然后根据1molH2O2中含2molH-O键来分析;
C、Fe3+是弱碱阳离子,在溶液中会水解;
D、反应中氯元素的价态由0降低为-1价.
解答:
解:A、氨气所处的状态不明确,不一定是标况,故所含的分子数无法计算,故A错误;
B、34gH2O2的物质的量为1mol,而1molH2O2中含2molH-O键,故B正确;
C、Fe3+是弱碱阳离子,在溶液中会水解,故溶液中Fe3+的个数小于0.1NA,故C错误;
D、反应后氯元素的价态为-1价,故1mol氯气转移2mol电子,故D错误.
故选B.
B、34gH2O2的物质的量为1mol,而1molH2O2中含2molH-O键,故B正确;
C、Fe3+是弱碱阳离子,在溶液中会水解,故溶液中Fe3+的个数小于0.1NA,故C错误;
D、反应后氯元素的价态为-1价,故1mol氯气转移2mol电子,故D错误.
故选B.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
浓度均为0.1mol?Lˉ1的下列各组溶液,pH前者大于后者的是( )
| A、Na2CO3、NaHCO3 |
| B、NaH2PO4、Na2HPO4 |
| C、NaHSO4、NaHCO3 |
| D、Na2SO4、CH3COONa |
下列说法正确的是( )
| A、反应热就是反应中放出的能量 |
| B、在任何条件下,化学反应的焓变都等于化学反应的反应热 |
| C、由C(s,石墨)═C(s,金刚石)△H=+1.9kJ?mol-1可知,金刚石比石墨稳定 |
| D、等量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多 |
下列实验操作中所用仪器合理的是( )
| A、用100 mL的量筒量取18.8 mL NaOH溶液 |
| B、用瓷坩埚加热熔融NaOH |
| C、用托盘天平称取25.2 0g氯化钠 |
| D、用100 m L容量瓶制备7 0 mL0.1 mo l?L-1盐酸 |
用NA表示阿伏加德罗常数,下列说法中不正确的是( )
| A、1g水中含氧原子数为 NA/18 |
| B、NA个CO2分子和NA个CO分子质量比为11:7 |
| C、18g水中含电子数为8NA个 |
| D、1mol Fe2+带2NA个正电荷 |
下列物质属于有机物的是( )
| A、CH4 |
| B、Na2CO3 |
| C、CO2 |
| D、CO(NH2)2(尿素) |
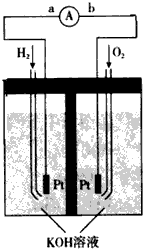 (1)氢氧燃料电池的能量转化主要形式是
(1)氢氧燃料电池的能量转化主要形式是