题目内容
关于卤素(用X表示)的下列叙述,错误的是( )
| A、卤素单质与水反应均可用X2+H2O=HXO+HX表示 |
| B、HX都极易溶于水,它们的热稳定性随X的核电荷数的增加而减小 |
| C、卤素单质的颜色由F2→I2按相对分子质量增大而变深 |
| D、X-的还原性依次为:F-<Cl-<Br-<I- |
考点:卤素原子结构及其性质的比较
专题:碳族元素
分析:A、氟气和水之间反应生成HF和氧气;
B、HX的热稳定性随着元素的原子的得电子的能力的减弱而减小;
C、卤素单质的颜色从上到下逐渐加深;
D、卤素单质的氧化性越强,对应离子的还原性越弱.
B、HX的热稳定性随着元素的原子的得电子的能力的减弱而减小;
C、卤素单质的颜色从上到下逐渐加深;
D、卤素单质的氧化性越强,对应离子的还原性越弱.
解答:
解:A、卤素单质中,氟气和水之间反应生成HF和氧气,不符合:X2+H2O=HXO+HX,故A错误;
B、卤素元素的原子的得电子的能力越强,HX的热稳定性越强,卤素原子的得电子能力随X的核电荷数的增加而减小,所以HX热稳定性随X的核电荷数的增加而减小,故B正确;
C、卤素单质的颜色从上到下逐渐加深,由F2→I2依次是浅黄绿色、黄绿色、橙红色、紫色,故C正确;
D、卤素单质的氧化性从上到下逐渐增强,对应离子的还原性F-<Cl-<Br-<I-,故D正确.
故选A.
B、卤素元素的原子的得电子的能力越强,HX的热稳定性越强,卤素原子的得电子能力随X的核电荷数的增加而减小,所以HX热稳定性随X的核电荷数的增加而减小,故B正确;
C、卤素单质的颜色从上到下逐渐加深,由F2→I2依次是浅黄绿色、黄绿色、橙红色、紫色,故C正确;
D、卤素单质的氧化性从上到下逐渐增强,对应离子的还原性F-<Cl-<Br-<I-,故D正确.
故选A.
点评:本题以卤族元素为载体考查学生元素周期律的有关知识,难度中等,注意知识的迁移和应用是关键.

练习册系列答案
相关题目
 亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻、纸浆等漂白亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出).则下列分析错误的是( )| A、含氯消毒剂中的有效氯含量是指含氯消毒剂的氧化能力相当于多少氯的氧化能力,则亚氯酸钠的理论有效氯含量157% |
| B、使用该漂白剂的最佳pH为3 |
| C、25℃时,HClO2的电离平衡常数的数值Ka=10-6 |
| D、若浓度均为0.1mol?L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(OH-)-c(H+)>c(HClO2)-c(ClO2-) |
对于易燃、易爆、有毒的化学物质,会在其包装上贴上危险警告标签.下面所列的物质中,标签贴错了的是( )
| A | B | C | D | |
| 物质的化学式 | 浓H2SO4 | 四氯化碳 | 三硫化二砷(砒霜) | KNO3 |
| 危险警告标签 |  |  |  |  |
| A、A | B、B | C、C | D、D |
下列说法中正确的是( )
| A、摩尔既是物质的数量单位又是物质的质量单位 |
| B、物质的量既表示物质的数量又表示物质的质量 |
| C、阿伏加德罗常数是12 kg 12C中含有的碳原子数目 |
| D、1 mol H2O中含有2 mol H原子和1mol O原子 |
某KCl、MgCl2、K2SO4形成的混合中,c(K+)=0.40mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.60mol/L,则c(SO42-)为( )
| A、0.30mol/L |
| B、0.20mol/L |
| C、0.15mol/L |
| D、0.10mol/L |
 一定温度下,在2L的密闭容器中发生反应:A(g)+2B(g)?xC(g)△H<0,B、C的物质的量随时间变化的关系如下图.下列有关说法不正确的是( )
一定温度下,在2L的密闭容器中发生反应:A(g)+2B(g)?xC(g)△H<0,B、C的物质的量随时间变化的关系如下图.下列有关说法不正确的是( )| A、x=2 |
| B、反应开始2min内,v(C)=0.1mol?L-1?min-1 |
| C、2min后,降低温度平衡向右移动 |
| D、当容器内混合气体压强不再改变时,反应体系达到化学平衡状态 |
有相同体积、相等pH的烧碱溶液和氨水,下列叙述中正确的是( )
| A、两溶液的物质量浓度相同 |
| B、用同浓度的盐酸中和时,消耗盐酸的体积相同 |
| C、升高温度10℃,两溶液的pH仍相等 |
| D、两溶液中OH-离子浓度相同 |
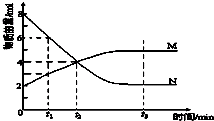 一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )| A、反应的化学方程式:2M?N |
| B、t2时,正、逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率为75% |
| D、若t1=2min,用N的浓度表示的化学反应速率为0.5 mol?(L?s)-1 |
下列有关化学能与热能的说法错误的是( )
| A、燃烧反应都属于放热反应 |
| B、化学反应必然伴随着能量的变化 |
| C、吸热反应是指需要加热才能进行的反应 |
| D、化学键的断裂和形成是化学反应中能量变化的主要原因 |