题目内容
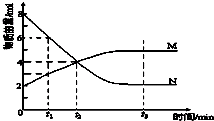 一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )| A、反应的化学方程式:2M?N |
| B、t2时,正、逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率为75% |
| D、若t1=2min,用N的浓度表示的化学反应速率为0.5 mol?(L?s)-1 |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A.由图可知,N减少,M增加,并利用量的变化来分析;
B.根据曲线的变化判断达到平衡状态的时间;
C.转化率为物质已转化的物质的量与总物质的量的百分比;
D.利用2min内,N的浓度的变化量计算.
B.根据曲线的变化判断达到平衡状态的时间;
C.转化率为物质已转化的物质的量与总物质的量的百分比;
D.利用2min内,N的浓度的变化量计算.
解答:
解:A.由图可知,N减少8-2=6,M增加5-2=3,N为反应物,M为生成物,且变化量之比为2:1,即化学计量数之比为2:1,反应为2N (g)?M (g),故A正确;
B.达到平衡状态时,各物质的物质的量不再发生变化,由曲线的变化可知t2时刻未达到平衡状态,此时正逆反应速率不相等,故B错误;
C.平衡时c(N)=2mol,转化率
×100%=75%,故C正确;
D.2min时,△c(N)=
=1mol/L,v=
=
=0.5 mol?(L?min)-1,故D错误;
故选C.
B.达到平衡状态时,各物质的物质的量不再发生变化,由曲线的变化可知t2时刻未达到平衡状态,此时正逆反应速率不相等,故B错误;
C.平衡时c(N)=2mol,转化率
| (8-2)mol |
| 8mol |
D.2min时,△c(N)=
| (8-6)mol |
| 2L |
| △c(N) |
| △t |
| 1mol/L |
| 2min |
故选C.
点评:本题考查化学反应与图象、平衡状态的判定、影响化学反应速率的因素等,明确化学反应速率与化学平衡的关系是解答本题的关键.

练习册系列答案
相关题目
下列物质在一定条件下,可与CH4发生取代反应的是( )
| A、酸性高锰酸钾 | B、溴水 |
| C、氧气 | D、氯气 |
关于卤素(用X表示)的下列叙述,错误的是( )
| A、卤素单质与水反应均可用X2+H2O=HXO+HX表示 |
| B、HX都极易溶于水,它们的热稳定性随X的核电荷数的增加而减小 |
| C、卤素单质的颜色由F2→I2按相对分子质量增大而变深 |
| D、X-的还原性依次为:F-<Cl-<Br-<I- |
下列说法正确的是( )
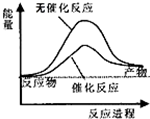

| A、如图可表示水分解过程中的能量变化 |
| B、高温高压下的超临界水,溶液中的氢离子和氢氧根离子浓度较大,有时显酸性,有时显碱性 |
| C、需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 |
| D、等体积、等浓度的醋酸钠溶液和次氯酸钠溶液中,所含离子总数,前者小于后者 |
下列关于碱金属的叙述正确的是( )
| A、随着核电荷数的增加,单质与水反应的剧烈程度增大 |
| B、随着核电荷数增加,单质的熔点.沸点升高 |
| C、随着核电荷数增加,它们的密度逐渐减小 |
| D、随着核电荷数增加,离子的氧化性逐渐增强 |
下列措施肯定能使反应速率增大的是( )
| A、增大反应物的量 |
| B、增大压强 |
| C、适当升高温度 |
| D、降低反应物浓度 |
下列反应属于吸热反应的是( )
| A、金属钠与水反应 |
| B、石灰石高温分解 |
| C、盐酸与氢氧化钠溶液反应 |
| D、甲烷在空气中燃烧 |
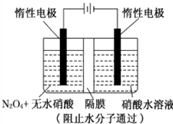 如图所示装置可通过发生“3N2O4+8HNO3=6N2O5+2NO+4H2O”制备N2O5,有关说法中错误的是( )
如图所示装置可通过发生“3N2O4+8HNO3=6N2O5+2NO+4H2O”制备N2O5,有关说法中错误的是( )| A、阴极的电极反应为:NO3-+4H++3e-=NO↑+2H2O |
| B、阳极的电极反应为:N2O4+2 HNO3-2e-=2N2O5+2H+ |
| C、当电路中通过6 mol e-时整个电解池中参与反应的HNO3为8mol |
| D、当电路中通过6 mol e-时,有8molH+从阳极向阴极迁移 |
下列说法正确的是( )
| A、酸、碱和盐类都属于电解质,其他化合物都是非电解质 |
| B、强电解质与弱电解质的本质区别,是其水溶液导电性的减弱 |
| C、电解质与非电解质的本质区别,是在水溶液或熔化状态下能否电离 |
| D、常见的强酸、强碱和大部分盐都是强电解质,其他化合 物都是非电解质 |