题目内容
17.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:A.Na2O2+2HCl═2NaCl+H2O2
B.Ag2O+H2O2═2Ag+O2↑+H2O
C.2H2O2═2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O
(1)上述反应中,不属于氧化还原反应的是A(填字母序号,下同).
(2)某强酸性反应体系中,反应物和生成物共六种物质或离子:O2、MnO4-QUOTE QUOTE、H2O、Mn2+、H2O2、H+.已知该反应中H2O2只发生了如下过程:H2O2→O2.
①该反应的离子方程式是2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O.
②如果上述反应中有2.24L(标准状况)气体生成,转移的电子的物质的量为0.2mol.
(3)H2O2可用于消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为KHCO3.
(4)请设计一个简单易行的实验证明过氧化氢具有氧化性.除过氧化氢外,供选择的试剂还有:酸性高锰酸钾溶液、二氧化锰粉末、亚硫酸钠溶液、饱和硫化氢溶液.请将所选试剂和实验现象填入下表:
| 实验内容 | 试剂 | 实验现象 |
| 验证氧化性 |
分析 (1)H2O2仅体现氧化性,则O元素的化合价降低;双氧水仅体现还原性,说明双氧水在反应中仅被氧化,化合价只升高;H2O2既体现氧化性又体现还原性,则O元素的化合价既升高又降低;H2O2既不做氧化剂又不做还原剂,说明在反应中双氧水的化合价不发生变化;
(2)H2O2只发生了如下过程:H2O2→O2↑,O元素的化合价升高,则与氧化剂反应,还原过程为MnO4-→Mn2+,结合电子、原子守恒分析;
(3)KCN+H2O2+H2O═A+NH3↑,由原子守恒确定A;
(4)实验证明过氧化氢具有氧化性,与还原剂反应即可,氯水、稀硝酸、饱和硫化氢溶液中只有硫化氢适合.
解答 解:(1)A.Na2O2+2HCl=2NaCl+H2O2,是一个非氧化还原反应,双氧水既不是氧化剂,也不是还原剂,故A选;
B.Ag2O+H2O2=2Ag+O2↑+H2O,Ag2O被还原成单质银,H2O2仅表现为还原性,其中氧元素转化为O2,故B不选;
C.2H2O2=2H2O+O2↑,过氧化氢的分解反应,是一个自身氧化还原反应,H2O2既表现了氧化性,又表现了还原性,故C不选;
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O,双氧水在反应中化合价由-1变成-2,化合价降低被还原,双氧水仅做氧化剂,故D不选;
故答案为:A;
(2)H2O2只发生了如下过程:H2O2→O2↑,O元素的化合价升高,则与氧化剂反应,还原过程为MnO4-→Mn2+,
①发生的离子反应为2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O;
②2.24L(标准状况)气体生成,由O元素的化合价变化可知,转移电子为$\frac{2.24L}{22.4L/mol}$×2×(1-0)=0.2mol,
故答案为:0.2;
(3)KCN+H2O2+H2O═A+NH3↑,由原子守恒可知A为KHCO3,
故答案为:KHCO3;
(4)实验证明过氧化氢具有氧化性,与还原剂反应即可,氯水、稀硝酸、饱和硫化氢溶液中只有硫化氢适合,则向过氧化氢中加入饱和硫化物溶液,产生淡黄色沉淀可说明,故答案为:
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | H2O2 饱和硫化氢溶液 | 产生淡黄色沉淀. |
点评 本题考查较综合,侧重氧化还原反应及实验的考查,把握反应中元素的化合价变化、物质的性质及守恒法为解答的关键,注意守恒法在解答中的应用,题目难度中等.

| 1 | 2 | 3 | 4 | 5 | 6 |
| CH4O | C2H4O2 | C4H8O2 | C5H12O | C6H12O2 |
| A. | 表格中的有机物1不可能与金属钠反应 | |
| B. | 空格中的有机物的同分异构体数目为3 | |
| C. | 空格中有机物燃烧一定生成CO2和H2O | |
| D. | 表格中2、4、6有机物不可能为同类物质 |
| A. | H2SO3+ClO-→2 H++SO42-+Cl- | B. | SO2+ClO-+H2O→2 H++SO42-+Cl- | ||
| C. | SO2+ClO-+H2O→SO32-+HClO | D. | SO2+ClO-+2OH-→SO42-+Cl-+H2O |
| A. | 某气体能使品红溶液褪色,则该气体是SO2 | |
| B. | 向无色溶液中加入氯水后振荡,再加入CCl4振荡,下层显示紫红色,则原溶液中有I- | |
| C. | 向某溶液中加入硝酸酸化Ba(NO3)2溶液,产生白色沉淀,则原溶液中有SO42- | |
| D. | 向某溶液中加入NaOH,产生可使湿润的蓝色石蕊试纸变红的气体,则原溶液中有NH4+ |
| A. | CaO | B. | Cl2 | C. | H2SO4 | D. | SO2 |
| A. | 2mol浓盐酸与足量MnO2 反应,可以得到0.5mol氯气 | |
| B. | 区别氯化钠溶液和氯化钾溶液,目前我们做不到 | |
| C. | 影响气体体积的主要因素是:分子大小、分子间距、分子数目 | |
| D. | 漂白粉露置空气中变质,既发生氧化反应又发生非氧化还原反应 |
①取部分溶液,逐滴滴入NaOH溶液至过量并微热,只观察到白色沉淀先增多后又部分溶解,无其它明显现象;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,无沉淀产生.
下列推断正确的是( )
| A. | 肯定有Al3+、Mg2+、Cl-,可能有K+ | |
| B. | 肯定有Al3+、Mg2+,可能有CO32- | |
| C. | 肯定有Al3+、Mg2+、Cl-,肯定没有NH4+ | |
| D. | 肯定有Al3+、Cl-,可能有Mg2+ |
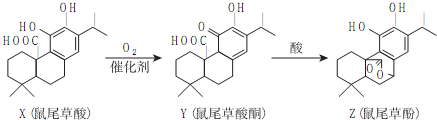
| A. | X、Z属于芳香族化合物 | |
| B. | X、Y、Z均能与FeCl3溶液发生显色反应 | |
| C. | 1molX或1molZ与NaOH溶液反应,均最多消耗3molNaOH | |
| D. | Z能与溴的四氯化碳溶液发生加成反应 |