题目内容
2.下列物质水溶液能导电,但该物质属于非电解质的是( )| A. | CaO | B. | Cl2 | C. | H2SO4 | D. | SO2 |
分析 在水溶液中能导电必须有自由移动的离子说明有电解质,若物质属于非电解质,则必须是非电解质溶于水后反应生成了电解质.
解答 解:A、CaO是电解质,溶于水生成氢氧化钠溶液导电,故A不符合;
B、Cl2是单质,溶于水生成电解质氯化氢和次氯酸,溶液能导电,故B不符合;
C、H2SO4是电解质,溶于水导电,故不符合;
D、SO2溶于水反应生成碳酸是电解质,溶液能导电,但CO2本身不能电离出离子是非电解质,故D符合;
故选D.
点评 本题考查了电解质、非电解质概念的应用,溶液导电的实质.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
7.下列操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列物质中既含有离子键又含有共价键的是( )
| A. | CO2 | B. | KOH | C. | MgCl2 | D. | Na2O |
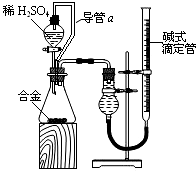
12.铁在工业和生活中都具有非常重要的应用.某含铁化合物W,为探究其成分,化学兴趣小组的同学取化合物W粉末进行试验.经组成分析,该粉末除Fe外还有O和另一未知元素共三种元素.另取2.22g化合物W的粉末溶于适量稀硫酸,向反应后的溶液中加入含有3.20gNaOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色粉末1.60g;将所得滤液在一定条件下蒸发灼烧可得到一种纯净的不含结晶水的盐7.10g.请回答:
(1)则另一未知元素为Na(填化学式).
(2)①该化合物W的化学式为NaFeO2.
②该化合物W与适量稀硫酸反应的化学方程式2NaFeO2+4H2SO4=Na2SO4+Fe2(SO4)3+4H2O.
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域.某研究小组在实验室探究CoC2O4分解反应的平衡常数.将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:
CoC2O4(S)?CoO(S)+CO(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
由表中数据,列式计算250℃时CoC2O4分解平衡常数2.89×10-6. 该反应的焓变△H>0(填“>”、“=”或“<”).
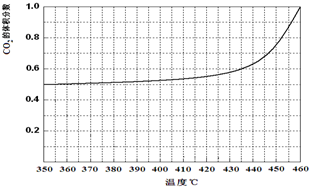
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:
试画出CO的体积分数随温度升高的曲线
(1)则另一未知元素为Na(填化学式).
(2)①该化合物W的化学式为NaFeO2.
②该化合物W与适量稀硫酸反应的化学方程式2NaFeO2+4H2SO4=Na2SO4+Fe2(SO4)3+4H2O.
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域.某研究小组在实验室探究CoC2O4分解反应的平衡常数.将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:
CoC2O4(S)?CoO(S)+CO(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 240 | 250 | 260 | 270 |
| 平衡总压强/kp | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:
试画出CO的体积分数随温度升高的曲线

 现有一瓶标签受到腐蚀(如图所示)的无色溶液,已知该溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠、硫化钠中的一种,为确定溶液的成分,同学们进行了如下探究:
现有一瓶标签受到腐蚀(如图所示)的无色溶液,已知该溶液可能是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠、硫化钠中的一种,为确定溶液的成分,同学们进行了如下探究:
 ,(若产物中有水生成则省略未表示出来).
,(若产物中有水生成则省略未表示出来).