题目内容
19.如表是元素周期表的一部分,短周期元素X的最高价氧化物对应水化物与其气态氢化物反应能得到离子化合物,则下列说法正确的是( )| W | X | Y | |
| Z |
| A. | 非金属性:Z>Y | |
| B. | 原子的半径:W<X | |
| C. | Z的氧化物能与Y的氢化物反应生成强酸 | |
| D. | Z一种单质熔点为119℃,易溶于二硫化碳,则该单质属于原子晶体 |
分析 由短周期元素X的最高价氧化物对应水化物与其气态氢化物反应能得到离子化合物,X为N元素,结合元素在周期表的位置可知,W为B,Y为O,Z为S,然后结合元素周期律及元素化合物知识来解答.
解答 解:由短周期元素X的最高价氧化物对应水化物与其气态氢化物反应能得到离子化合物,X为N元素,结合元素在周期表的位置可知,W为B,Y为O,Z为S,
A.同主族从上到下非金属性减弱,则非金属性:Y>Z,故A错误;
B.同周期从左向右原子半径减小,则原子的半径:W>X,故B错误;
C.Z的氧化物(三氧化硫)能与Y的氢化物(水)反应生成强酸(硫酸),故C正确;
D.Z一种单质熔点为119℃,易溶于二硫化碳,则该单质属于分子晶体,故D错误;
故选C.
点评 本题考查位置、结构与性质,为高频考点,把握元素在周期表的位置、元素周期律、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意X为N解答的突破口,题目难度不大.

练习册系列答案
相关题目
16.检验KCl溶液中是否混有Fe3+时,可选择的试剂是( )
| A. | 硫氰酸钾溶液 | B. | 硝酸 | C. | 盐酸 | D. | 硫酸 |
17.下列物质的性质与其应用对应关系正确的是( )
| A. | 碳酸氢钠能发生水解反应,可用作食品的膨松剂 | |
| B. | 四氯化碳密度比水大,可用于萃取溴水中的Br2 | |
| C. | O3能使蛋白质发生变性,可用于杀菌、消毒 | |
| D. | SO2具有漂白性,可用KMn04标准溶液滴定食品中S02残留量. |
7.下列烃在光照下与氯气反应,只生成一种一氯代物的有( )
| A. | 2-甲基丙烷 | B. | 异戊烷 | C. | 2,2-二甲基丙烷 | D. | 2,2-二甲基丁烷 |
14. 长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
 长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )
长效缓释阿司匹林对感冒发烧,各种镇痛有疗效,其结构简式如图所示,下列关于该有机物的说法正确的是( )| A. | 能发生取代反应、加成反应、消去反应 | |
| B. | 1mol该物质中含有苯环的物质的量为1mol | |
| C. | 该物质在酸性条件下加热水解可以得到乙醇 | |
| D. | 与足量NaOH溶液反应,最多消耗4nmolNaOH |
4.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+,取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知有关原溶液中( )
| A. | 至少存在5种离子 | |
| B. | SO42-、NH4+、一定存在,Cl-可能不存在 | |
| C. | Cl-一定存在,且c(Cl?)≥0.4mol/L | |
| D. | CO32-、Al3+一定不存在,K+可能存在 |
8.X、Y、Z、W是原子序数依次增大的短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 元素Y分别与元素Z、W形成的化合物中化学键类型相同 | |
| C. | 元素Z和元素Y、W均能形成离子化合物 | |
| D. | 四种元素形成的氢化物中,沸点最高的是元素Y的氢化物 |
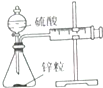


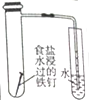
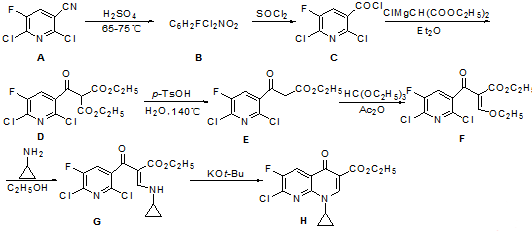
 .由C→D的反应类型是取代反应.
.由C→D的反应类型是取代反应. (其中一种).
(其中一种).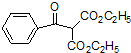 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: