题目内容
4.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+,取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知有关原溶液中( )| A. | 至少存在5种离子 | |
| B. | SO42-、NH4+、一定存在,Cl-可能不存在 | |
| C. | Cl-一定存在,且c(Cl?)≥0.4mol/L | |
| D. | CO32-、Al3+一定不存在,K+可能存在 |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
解答 解:加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子,红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,
A.由上述分析可知,一定含SO42-、NH4+、Fe3+,溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,
据电荷守恒,知溶液中必然大量存在另一种阴离子Cl-,至少存在4种离子,故A错误;
B.由上述分析可知,Cl-、SO42-、NH4+一定存在,故B错误;
C.由电荷守恒可知,Cl-一定存在,且c(Cl-)≥0.4mol/L,故C正确;
D.综上所述,原溶液中一定含Fe3+、NH4+、SO42-和Cl-,可能含Al3+、K+,一定不含CO32-,故D错误;
故选C.
点评 本题考查物质的检验及推断,为高考常见题型和高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意常见离子的性质和反应类型的判断,答题时认真阅读、分析题中数据,合理分析,特别是氯离子的推断,注意电荷守恒的应用,题目难度中等.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
1.下列俗名与物质相匹配的一组是( )
| A. | 水玻璃-Na2SO4 | B. | 石膏-CaSiO3 | C. | 小苏打-NaHCO3 | D. | 胆矾-FeSO4 |
2.把动物的脂肪和氢氧化钠溶液混合,加热,得到一种均匀的液体,然后向其中加入足量的盐酸,结果有一种白色的物质析出,这种白色的物质是( )
| A. | NaCl | B. | 肥皂 | C. | C17H35COONa | D. | 高级脂肪酸 |
12.宋应星在《天工开物.丹青.朱》中记载:“凡朱砂、水银、银朱,原同一物,所以异名着,由精粗老嫩而分也…凡水银与朱更无他出…若水银已升朱,则不可复还为汞,所谓造化之巧已尽也.”(注“即朱砂,主要成分是HgS)下列说法不正确的是( )
| A. | “若水银已升朱”指的是水银气化,属于物理变化 | |
| B. | 朱砂、水银、银朱中均含汞元素,其组成、结构或纯度有所不同 | |
| C. | 常温下,朱砂转化为水银是不自发的过程 | |
| D. | 工业废水中含有汞离子,可以加入FeS固体除去 |
19.如表是元素周期表的一部分,短周期元素X的最高价氧化物对应水化物与其气态氢化物反应能得到离子化合物,则下列说法正确的是( )
| W | X | Y | |
| Z |
| A. | 非金属性:Z>Y | |
| B. | 原子的半径:W<X | |
| C. | Z的氧化物能与Y的氢化物反应生成强酸 | |
| D. | Z一种单质熔点为119℃,易溶于二硫化碳,则该单质属于原子晶体 |
9.在短周期主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数,这四种元素原子的最外层电子数之和为20.下列判断中正确的是( )
| A. | 四种元素中,甲的最高价氧化物对应水化物的酸性最强 | |
| B. | 四种元素中,丙的气态氢化物最稳定 | |
| C. | 乙在自然界中形成的化合物种类最多 | |
| D. | 丁和甲、乙、丙都只能形成一种共价化合物 |
16.化学在生活、生产中应用广泛.下列有关物质的性质和应用均正确的是( )
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 漂白粉和二氧化硫均具有漂白性,将两者混合使用,可增强漂白效果 | |
| C. | 酒精能使蛋白质变性,医院一般用100%的酒精进行消毒 | |
| D. | 氧化铝熔点很高,其制造的坩埚可用于熔融烧碱 |
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 常温常压下,1 L0.1mol•L-1的硝酸铵溶液中氮原子数目为0.2NA | |
| B. | 标准状况下,6.0gNO和2.24LO2混合,所得气体的分子数目为0.2NA | |
| C. | 1 mol有机物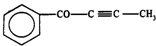 中最多有6 NA个原子在一条直线上 中最多有6 NA个原子在一条直线上 | |
| D. | 1 mol甲基(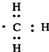 )所含的电子数为7 NA )所含的电子数为7 NA |