题目内容
11.下列实验装置不能达到实验目的是( )| 选项 | A | B | C | D |
| 装置 | 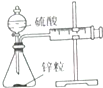 |  |  | 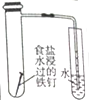 |
| 实验 | 结合秒表测量锌与硫酸的反应速率 | 石油的分馏 | 验证化学能转化为电能 | 铁的吸氧腐蚀实验 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.关闭分液漏斗的活塞,利用针筒可测定一定时间内气体的体积;
B.分馏时测定馏分的温度;
C.图中装置可构成原电池;
D.食盐水为中性,试管中水沿导管上升.
解答 解:A.关闭分液漏斗的活塞,利用针筒可测定一定时间内气体的体积,则图中装置可测定反应速率,故A正确;
B.分馏时测定馏分的温度,图中温度计的位置不合理,水银球应在烧瓶支管口处,故B错误;
C.图中装置可构成原电池,则图可验证化学能转化为电能,故C正确;
D.食盐水为中性,试管中水沿导管上升,可知发生吸氧腐蚀,则图中装置为铁的吸氧腐蚀实验,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握反应原理、混合物分离提纯实验、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
8.下列物质中,不能作为食品添加剂的是( )
| A. | 白醋 | B. | 白酒 | C. | 甲醇 | D. | 食盐 |
2.分子式与苯丙氨酸(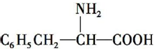 )相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )
)相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )
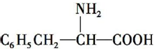 )相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )
)相同,且同时符合下列条件:①有带两个取代基的苯环,②有一个硝基直接连接在苯环上,这种同分异构体的数目为( )| A. | 3种 | B. | 6种 | C. | 8种 | D. | 10种 |
19.如表是元素周期表的一部分,短周期元素X的最高价氧化物对应水化物与其气态氢化物反应能得到离子化合物,则下列说法正确的是( )
| W | X | Y | |
| Z |
| A. | 非金属性:Z>Y | |
| B. | 原子的半径:W<X | |
| C. | Z的氧化物能与Y的氢化物反应生成强酸 | |
| D. | Z一种单质熔点为119℃,易溶于二硫化碳,则该单质属于原子晶体 |
6.化学与资源、环境、生活关系密切,下列说法正确的是( )
| A. | 空气中PM2.5微米以下的颗粒物的存在一定能够形成丁达尔效应 | |
| B. | 煤燃烧时加入少量的生石灰可以减少废气中的二氧化硫排放 | |
| C. | 将造纸废水通过高压水井压到地下,节约成本 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
16.化学在生活、生产中应用广泛.下列有关物质的性质和应用均正确的是( )
| A. | 液氨汽化时吸收大量的热,可用作制冷剂 | |
| B. | 漂白粉和二氧化硫均具有漂白性,将两者混合使用,可增强漂白效果 | |
| C. | 酒精能使蛋白质变性,医院一般用100%的酒精进行消毒 | |
| D. | 氧化铝熔点很高,其制造的坩埚可用于熔融烧碱 |
3.如表由实验现象得出的结论正确的是( )
| 操作及现象 | 结论 | |
| A | 向AgCl悬浊液中加入NaI溶液时出现黄色沉淀. | Ksp(AgCl)<Ksp(AgI) |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色. | 溶液中一定含有Fe2+ |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| A. | A | B. | B | C. | C | D. | D |
20.毒重石的主要成分BaCO3(含Ca3+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如图:
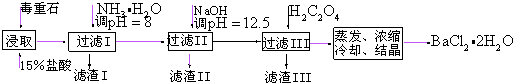
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
加入NH•H2O调节pH=8可除去Fe3+(填离子符号),滤渣Ⅱ中含Mg(OH)2、Ca(OH)2(填化学式).加入H2C2O4时应避免过量,原因是H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少.
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(Ca C2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H2O Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$ mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).

(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而使反应速率加快.实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的ac.
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(Ca C2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行.
已知:2CrO42-+2H+═Cr2O72-+H2O Ba2++CrO42-═BaCrO4↓
步骤Ⅰ移取xml一定浓度的Na2CrO溶液与锥形瓶中,加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL.
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol•L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL.滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的上方(填“上方”或“下方”).BaCl2溶液的浓度为$\frac{(V{\;}_{0}-V{\;}_{1})b}{y}$ mol•L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将偏大(填“偏大”或“偏小”).
1.下列关于有机物的叙述正确的是( )
| A. | 油脂、糖类、蛋白质均能在一定条件下发生水解反应 | |
| B. | 乙烯能使溴水、高锰酸钾酸性溶液褪色,且褪色原理相同 | |
| C. | 棉、麻、羊毛、蚕丝均属于天然高分子材料 | |
| D. | 石油的分馏与煤的干馏主要是通过物理变化得到成分不同的有机物 |