题目内容
14.下列有关化学用语表示正确的是( )| A. | 氢氧根离子的电子式  | |
| B. | 硫原子的结构示意图 | |
| C. | 一氯乙烷的结构式CH3CH2Cl | |
| D. | 中子数为146、质子数为92 的铀(U)原子${\;}_{92}^{146}$U |
分析 A.氢氧根离子为阴离子,电子式中需要标出原子的最外层电子及带有的电荷;
B.硫原子核电荷数为16,核外电子分三层排布,分别为2、8、6;
C.结构式是表示用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子;
D.根据原子符号ZAX书写,质量数=质子数+质子数.
解答 解:A.氢氧根离子为阴离子,电子式中需要标出电荷及原子的最外层电子,氢氧根离子的电子式为: ,故A正确;
,故A正确;
B.硫原子的结构示意图为 ,故B错误;
,故B错误;
C.一氯乙烷的结构式为: ,CH3CH2Cl此为其结构简式,故C错误;
,CH3CH2Cl此为其结构简式,故C错误;
D.U原子质子数是92,原子核内有146个中子,质量数=,92+146=238,所以原子符号为$\underset{\stackrel{238}{\;}}{92}\underset{\stackrel{\;}{U}}{\;}$,故D错误;
故选A.
点评 本题考查学生化学用语的书写,题目难度不大,注意一氯乙烷的结构式的书写,易把结构简式当成结构式,为易错点.

练习册系列答案
相关题目
2.在由铜、锌、稀硫酸组成的原电池中,下列说法正确的是( )
| A. | 正极发生的电极反应为:Zn-2e-═Zn2+ | |
| B. | 正极发生的电极反应为:2H++2e-═H2↑ | |
| C. | 负极发生还原反应 | |
| D. | 电子经导线由铜流向锌 |
19.一定条件下,在密闭容器中充入1mol N2和3mol H2进行如下反应:N2(g)+3H2(g)?2NH3(g),当N2、H2、NH3的浓度不再改变时,下列说法正确的是( )
| A. | N2、H2完全反应生成2mol NH3 | B. | N2、H2、NH3的浓度一定相等 | ||
| C. | 反应已达到化学平衡状态 | D. | 正、逆反应速率相等且等于零 |
3.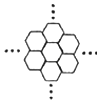 据报道,科学家已经研制出世界上最薄的材料--碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成.下列有关碳膜片的说法中正确的是( )
据报道,科学家已经研制出世界上最薄的材料--碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成.下列有关碳膜片的说法中正确的是( )
 据报道,科学家已经研制出世界上最薄的材料--碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成.下列有关碳膜片的说法中正确的是( )
据报道,科学家已经研制出世界上最薄的材料--碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成.下列有关碳膜片的说法中正确的是( )| A. | 碳膜片中每个六边形平均由两个碳原子构成 | |
| B. | 碳膜片与C60是同一种物质 | |
| C. | 碳膜片属于人工合成的有机化合物 | |
| D. | 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 |
4.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 在铁门上焊接铜块既美观,又能防腐蚀 | |
| B. | 古代青铜文物在干燥环境中的腐蚀比潮湿环境中快 | |
| C. | 纯银器表面在空气中因化学腐蚀渐渐变暗 | |
| D. | 可将地下输油管与外加直流电源的正极相连以保护它不受腐蚀 |