题目内容
4.已知16克A和20克B恰好完全反应生成0.04mol C和34.4克D,则C的摩尔质量为.( )| A. | 63 g•mol-1 | B. | 122 g•mol-1 | C. | 40g•mol-1 | D. | 163 g•mol-1 |
分析 先根据质量守恒计算C的质量,再根据M=$\frac{m}{n}$计算其摩尔质量.
解答 解:根据质量守恒定律,16g+20g=34.4g+m(C),解得m(C)=1.6g,
则M=$\frac{m(C)}{n}$=$\frac{1.6g}{0.04mol}$=40g•mol-1,
故选C.
点评 本题考查了有关摩尔质量的计算,难度不大,根据质量守恒定律和公式M=$\frac{m}{n}$计算即可.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol | |
| D. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol |
5.下列各组纯净物中,其分子内部都存在极性键且均为共价化合物的是( )
| A. | H2、NH3、SO3 | B. | CO2、CH4、C2H5OH | C. | NO、CaO、Ne | D. | P4、CS2、Na2CO3 |
12.普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )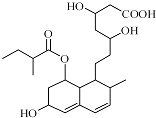

| A. | 该分子中有三种官能团 | B. | 能与FeCl3溶液发生显色反应 | ||
| C. | 能发生加成、取代、消去反应 | D. | 1mol该物质最多可与1molNaOH反应 |
19.浓盐酸与次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.用贮存很久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是①CO2;②HCl;③H2O(气);④O2( )
| A. | ①②③④ | B. | ②③④ | C. | ②③ | D. | ①④ |
9.X、Y、Z、M、W为原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍.Z与其同主族的短周期元素可形成常见气体甲.X、Y、Z 3种元素形成化合物乙.下列说法错误的是( )
| A. | 气体甲可与Z的某种氢化物反应生成强酸 | |
| B. | 化合物乙中一定只有共价键 | |
| C. | W元素的某种单质可在电子工业用于生产半导体材料 | |
| D. | X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
16.下列叙述正确的是( )
| A. | 在标准状况下,1 mol任何物质的体积约为22.4 L | |
| B. | 1 mol气体的体积约为22.4 L | |
| C. | 1 mol氖气和1 mol氧气体积相同 | |
| D. | 在标准状况下,1 mol氖气和氯气混合气体(任意体积比)的体积约为22.4 L |
13.丹参素能明显抑制血小板的聚集,其结构如图所示,下列说法错误的是( )


| A. | 丹参素的分子式为C9H9O5 | |
| B. | 丹参素能发生缩聚、消去、氧化反应 | |
| C. | 1 mol丹参素最多可以和4 mol H2发生加成反应 | |
| D. | 丹参素分子中含有手性碳原子 |
14.已知:Fe2O3(s)+$\frac{3}{2}$C(s)═$\frac{3}{2}$CO2(g)+2Fe(s)△H=+234.14kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)的△H是( )
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)的△H是( )
| A. | -824.39 kJ•mol-1 | B. | +627.6 kJ•mol-1 | ||
| C. | -744.7 kJ•mol-1 | D. | -169.4 kJ•mol-1 |